CellASIC® ONIX2
マイクロ流体システム
ライブセルイメージングプラットフォーム

CellASIC ONIX2だから実現できる3つのポイント:
ポイント1 二次元培養下でのタイムラプス実験
ポイント2 正確な培養環境制御が簡単に実現
ポイント3 ラボでお使いの倒立顕微鏡に設置可能
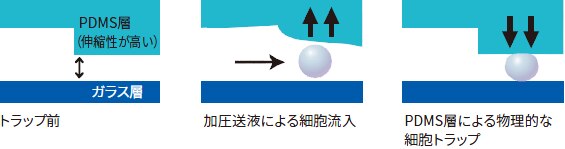
細胞種ごとに最適化された灌流プレート
酵母用プレート
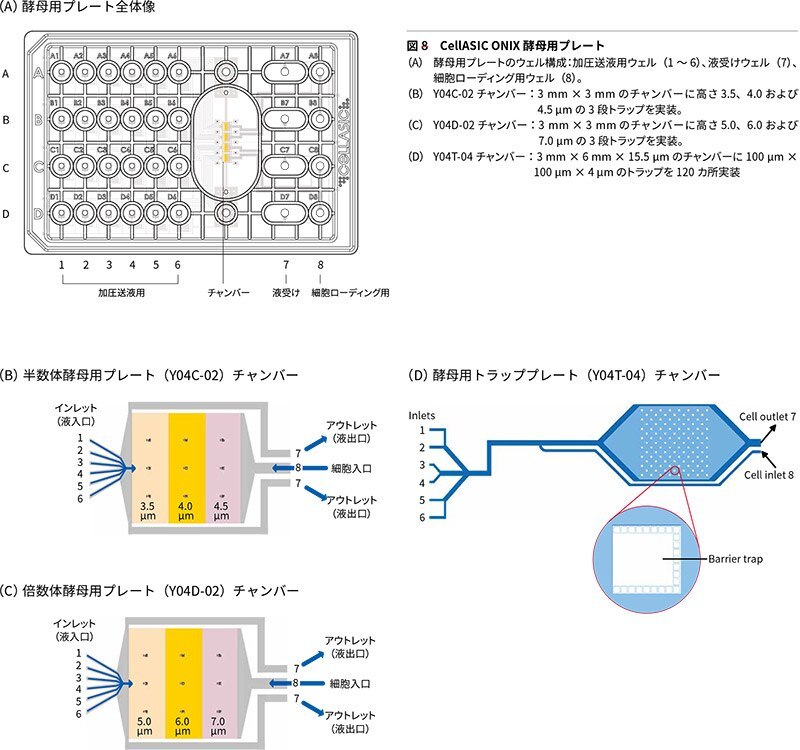
バクテリア(細菌)用プレート
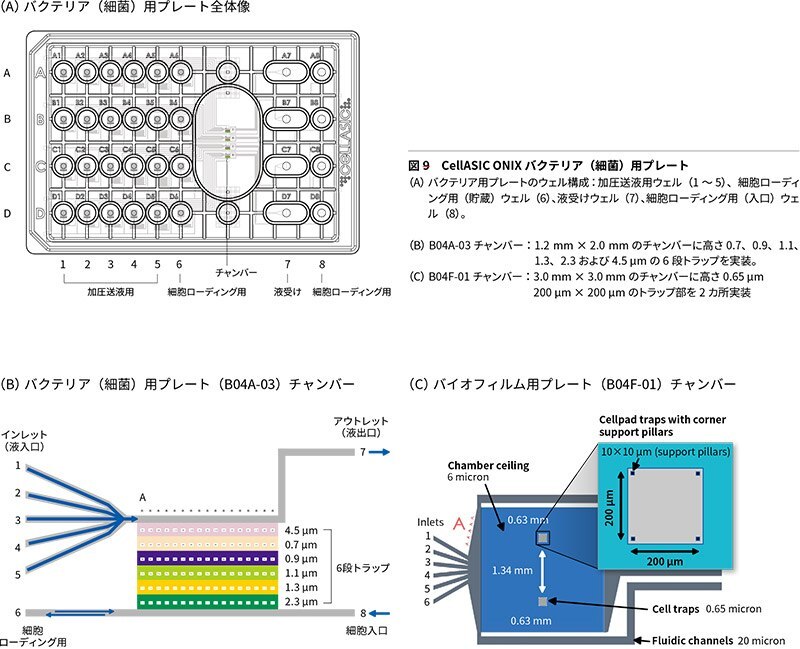
哺乳類細胞用プレート
アプリケーション紹介
ライブセルイメージングを行いながら、培地の切り換え、薬剤の正確な添加やウォッシュアウトなど多様な実験系をデザインできます。
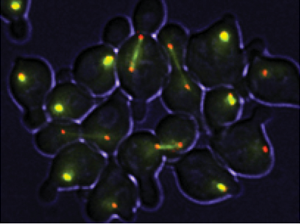
酵母の単一細胞応答解析
出芽酵母(S.cerevisiae)の減数分裂解析
データ提供:インディアナ大学ブルーミントン校Lacefield S. 博士からご提供いただきました。
掲載論文:PLoS Genet. (2014), 10: e1004398
Positive Feedback of NDT80 Expression Ensures Irreversible Meiotic Commitment in Budding Yeast
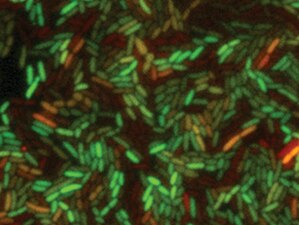
バクテリアのシングル細胞応答解析
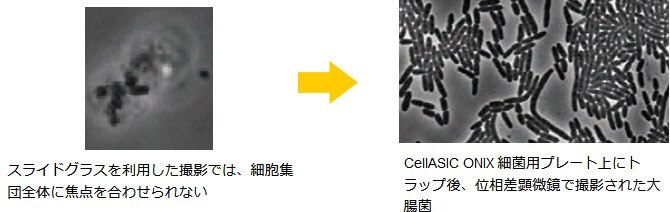
GFPタンパク質発現大腸菌(E.coli)のタイムラプス撮影
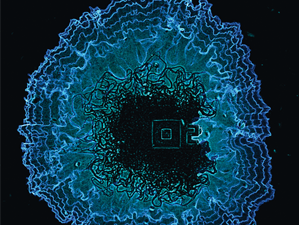
バクテリアのバイオフィルム解析
長時間培養による枯草菌(B.subtils)のバイオフィルム増殖解析
データ提供:カリフォルニア大学サンディエゴ校 Suel G. M. 博士からご提供いただきました。
掲載論文:Nature (2015), 523 (7562), p.550-554
B04Aプレートにおける 抗生物質による溶菌 - アンピシリンの抗菌効果による細胞膜への作用を視覚化するため、アンピシリン存在下でE. coliを培養しました。アンピシリン添加まで細胞の成長と分裂は正常でしたが、添加によって細胞は破裂[溶菌]しました。顕微鏡は100倍の対物レンズ搭載したNikon Plan、10分ごとに5時間撮像を行いました。
- ワシントン大学(シアトル)のSonia Singhal、Rob Egbert、Eric Klavins各氏の好意により転載。
B04AプレートにおけるE.coliの増殖- B04マイクロ流体プレートにおけるE. coli(BL21)の増殖の様子。細胞をLB培地でかん流し、100倍の油浸位相差対物レンズで撮像しました。細胞はマサチューセッツ工科大学のTim Lu氏から好意により提供をいただきました。
B04Aプレートにおけるマイコバクテリウムの増殖 - プレートを用いて8時間にわたり連続かん流培養したMycobacterium smegmatis 増殖の様子。100倍の位相差対物レンズで撮像しました。細胞はアルバート・アインシュタイン医科大学のTravis Hartman、William Jacobs 各氏の好意により提供いただきました。
動画:酵母
Y04Cプレートにおける分裂酵母の増殖 - Y04Cプレートにおける S.japonicus の増殖。国立遺伝学研究所の仁木宏典教授から提供いただきました。
Y04Cプレートにおける位相差顕微鏡を用いた解析 - Y04Cプレートにおける、24℃、5 psi、 CSmediumかん流下でのS. cerevisiaeの増殖。 150倍の油浸対物レンズで60秒ごとに撮像しました。NIH国立がん研究所(米国)のJan Wisniewski氏の好意により掲載しています。
Y04C分裂酵母の増殖 - Y04CプレートにおけるYES培地連続かん流下での S. pombeの増殖。細胞はForsburg Lab(南カリフォルニア大学)から好意により提供いただきました。
Y04Cプレートにおける細胞周期停止および放出 - SC培地中で4時間にわたり60倍の対物レンズで S. cerevisiaeを撮像した後、α因子に暴露して細胞周期を停止させました。細胞はGFP融合チューブリンおよび mCherry融合Spc42を発現する。撮像間隔は10分です。インディアナ大学のSoni Lacefield氏の好意により転載しました。
動物細胞、M04プレートの動画
M04Sプレートにおける低酸素環境下でのがん細胞の様子 - 16時間の20%O2環境下での培養後0% O2 の低酸素環境に切替え、BioTracker 520(SCT520)を使い染色し観察をおこなった。
M04Gプレートにおける細胞走化性の観察 - ヒト繊維芽細胞HT-1080を播種後、10%FBS添加培地を上部チャンネルから、0%FBS添加培地を下部チャンネルから灌流させ、細胞の走化性を観察した。
M04SプレートにおけるEGFレセプターの内面化の様子 - A549 GFP-EGFR細胞株(CLL1141) を播種後オーバーナイトで培養し、翌日EGF(E9644)を含むDMEMを灌流しながら観察を行った。
M04Sプレートにおけるマクロファージの食作用の観察 - フィブロネクチンでコーティングしたプレート上でヒトマクロファージM1細胞を培養し、GFP E. coli を添加し3分毎のタイムラプス撮影で食作用の観察を行った。
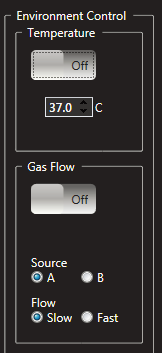
温度・ガス環境の正確な制御ができるから、無酸素・低酸素環境での培養も可能
温度制御モード画面
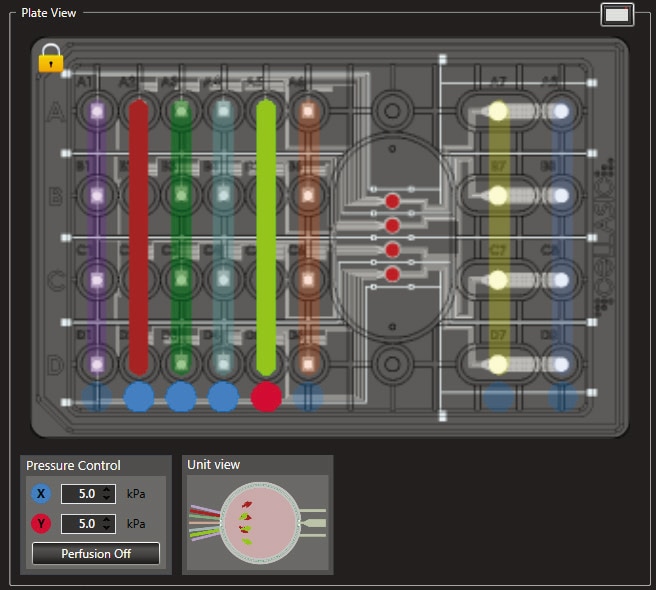
Dual Pressure モード画面
ポイント3 ラボでお使いの倒立顕微鏡に設置可能
CellASIC ONIX2なら、普段お使いの倒立顕微鏡に組み合わせるだけで、簡単にマイクロ流路技術によるライブセルイメージングを始められます。

✔ 各顕微鏡メーカー*の倒立型顕微鏡に適合
✔ 共焦点顕微鏡や超高解像度撮影モードでの撮影も可能
✔ 30分で設置完了**
*適合顕微鏡例:Nikon社 Tiシリーズ、Olympus社 IXシリーズ、Leica社 DMIシリーズ、Zeiss社 Axio Vertシリーズ、Thermofisher社 EVOSシリーズ、BioTek社 Lionheart、キーエンス社 BZ-Xシリーズ (その他の顕微鏡をお使いの場合はお問い合わせください)
** 96ウェルプレートを設置可能なステージおよび装置制御用のウィンドウズPCが必要です。
お客様の声
「CellASIC ONIX2は細菌を灌流培養しながら、顕微鏡で経時観察する際にとても便利なシステムです。我々は細菌の細胞質内タンパク質の動態や、抗菌薬を加えたときの生死・形態を観察することに用いています。細菌をプレートのガラス層に物理的にトラップできるので、液体培地の交換を行っても焦点がズレることなく同視野で同じ個体を観察することが可能です。制御ソフトウェアのUIが分かりやすく、実験条件の検討が簡単に行えるので、効率的にデータが取得できることが魅力です。今後、バイオフィルム解析用プレートのリリースを期待しています。」
鈴木 仁人様 国立感染症研究所 薬剤耐性研究センター
「留学先の研究室で実験を行って以来、長期にわたってCellASICにはお世話になっています。市販されている酵母やバクテリア用のマイクロ流路があまりないこともあり、我々の研究分野ではCellASICを使用している研究者が非常に多く、実験系の再現やデータの比較を行いやすいです。細胞種に最適化されたプレートを購入できるため実験系の立ち上げも簡単で使い勝手が良く、今では毎週2、3回使っています。欲を言えば、プレートの種類が更に増えると嬉しいですね。」
吉田 知史先生 早稲田大学 国際教養学部
「私はミトコンドリアの形態の定量を目標としているため、細胞を健康的な状態に維持することの出来る持続性かつ安定的な解析方法を必要としています。CellASIC® ONIXシステムはそれにぴったりです」
Marshall Lab、カリフォルニア大学サンフランシスコ校
「...これまでにマイクロ流路を使った実験経験がない我々でも、新しい高度な技術を必要とする実験を素早く簡単に実施することができました。私が重要な生物学的な疑問に集中することができたのはCellASIC®がその疑問を解決するのに必要なツールを提供してくれたからでした」
Maheshri Lab、マサチューセッツ工科大学
セルシグナリングの研究者は、動的なシングルセル解析により答えをすばやく得ることができました。
ハーバード大学の生物学者は驚くべき発見をしている
論文リスト
CellASIC ONIXを使用した研究実績として、100報以上の査読付き文献が存在します。ここでは代表的な文献を紹介します。
バクテリア用のプレートを実験に使用している主要論文
Donovan C. et al. “Chromosome segregation impacts on cell growth and division site selection in Corynebacterium glutamicum.”
PLoS One., 2013, 8(2), e55078 (doi: 10.1371/journal.pone.0055078)
Rojas E. et al. “Response of Escherichia coli growth rate to osmotic shock.”
PNAS, 2014, 111(21) (doi: 10.1073/pnas.1402591111)
Panas W. M. et al. “Noncanonical SMC protein in Mycobacterium smegmatis restricts maintenance of Mycobacterium fortuitum plasmids.”
PNAS, 2014 111 (37) (doi: 10.1073/pnas.1414207111)
Liu J. et al. “Metabolic co-dependence gives rise to collective oscillations within biofilms”
Nature 523 (7562) (doi: 10.1038/nature14660)
Lee DD., et al. “Magnesium Flux Modulates Ribosomes to Increase Bacterial Survival”
Cell 177 (2) (doi: 10.1016/j.cell.2019.01.042)
Mayer C. et al. “Consequences of dosing and timing on the antibacterial effects of ADEP antibiotics”
INT J MED MICROBIOL, 309 (7) (doi: 10.1016/j.ijmm.2019.151329)
酵母用用のプレートを実験に使用している主要論文
Furuya K. and Niki H. “The DNA damage checkpoint regulates a transition between yeast and hyphal growth in Schizosaccharomyces japonicus.”
Mol. Cell. Biol., 2010, 30(12) (doi: 10.1128/MCB.00049-10)
Kono K. et al. “Proteasomal degradation resolves competition between cell polarization and cellular wound healing. ”
Cell, 2012, 150(1) (doi: 10.1016/j.cell.2012.05.030)
Rafelski SM. et al. “Mitochondrial network size scaling in budding yeast. ”
Science, 2012, 338(6108), (doi: 10.1126/science.1225720)
Meyer R. et al. “Mps1 and Ipl1/Aurora B act sequentially to correctly orient chromosomes on the meiotic spindle of budding yeast.”
Science, 2013, 339(6123) (doi: 10.1126/science.1232518)
Guérin M T. et al. “Condensin-Mediated Chromosome Folding and Internal Telomeres Drive Dicentric Severing by Cytokinesis”
Mol. Cell, 75 (1) (doi: 10.1016/j.molcel.2019.05.021)
Knapp D B. et al. “Decoupling of Rates of Protein Synthesis from Cell Expansion Leads to Supergrowth”
Cell Systems, 9 (5) (doi: 10.1016/j.cels.2019.10.001)
哺乳類細胞用のプレートを実験に使用している主要論文
Park J.S. et al. “Synthetic control of mammalian-cell motility by engineering chemotaxis to an orthogonal bioinert chemical signal.”
PNAS, 2014, 111(16) (doi: 10.1073/pnas.1402087111)
Changou C. A. et al. “Arginine starvation-associated atypical cellular death involves mitochondrial dysfunction, nuclear DNA leakage, and chromatin autophagy.”
PNAS, 2014, 111(39), (doi: 10.1073/pnas.1404171111)
Zambrano S. et al. “NF-κB oscillations translate into functionally related patterns of gene expression.”
eLife 2016, 5, e09100, (doi: 10.7554/eLife.09100)
Han H. H. et al. “Angiopoietin-2 promotes ER+ breast cancer cell survival in bone marrow niche.”
Endocr Relat Cancer. 2016 23(8) (doi: 10.1530/ERC-16-0086)
Hartwell B. L. et al. “Antigen-Specific Binding of Multivalent Soluble Antigen Arrays Induces Receptor Clustering and Impedes B Cell Receptor Mediated Signaling.”
Biomacromolecules, 2016, 17 (3) (doi: 10.1021/acs.biomac.5b01097)
Dikova V. et al. “Metabolic interaction of hydrogen peroxide and hypoxia in zebrafish fibroblasts.”
Free Radic Biol Med, 2019 (doi: 10.1016/j.freeradbiomed.2019.11.015)
上記以外の論文、または哺乳類細胞の論文などご興味ある方はお気軽にお問合わせください。
CellASIC ONIX2 微小流体システム適応例
ご注文情報
装置 ※装置本体Ⓐと、ご希望のマニフォールド(Ⓑまたは©)を併せてご注文ください。
専用プレート(必須消耗品)
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?