COVID-19(SARS-CoV-2)研究のためのマルチプレックスアッセイ:Multiplex Your COVID-19 Research
- SARS-CoV-2ウイルスを構成するタンパク質
- SARS-CoV-2抗原に対するヒト免疫グロブリン検出のためのマルチプレックスアッセイ
- サイトカインストームとは?
- COVID-19(SARS-CoV-2)とサイトカインストーム
- サイトカインストームに関連するCOVID-19研究のためのマルチプレックスアッセイ
- 新たなCOVID-19研究領域のためのマルチプレックスアッセイ
- MILLIPLEX®キットを用いたCOVID-19オンデマンドウェビナー
- MILLIPLEX®キットを用いたCOVID-19研究の文献
- 参考文献
MIILIPLEX®などのマルチプレックスイムノアッセイにより、多数のヒトサイトカイン、ケモカイン、成長因子を同時に定量し、SARS-CoV-2抗原に対するヒト免疫グロブリンを検出することができます。このことにより、研究者はサイトカインストームを含むCOVID-19に対する免疫反応をより理解できるようになります。また、これらのマルチプレックスバイオマーカーアッセイが、血管新生や血液凝固障害など、SARS-CoV-2研究の新たな研究領域の発見にどのように役立つかをご覧ください。
SARS-CoV-2ウイルスを構成するタンパク質
複数のタンパク質がSARS-CoV-2ウイルスを形成します。ウイルスの「コロナ(王冠様突起)」を形成するスパイクタンパク質(S)は、受容体結合ドメイン(RBD)を含むサブユニット1(S1)と、サブユニット2(S2)から構成されます。スパイクタンパク質(S)は、膜糖タンパク質(M)とエンベロープタンパク質(E)の周りを取り囲んでおり、それらの内側にはヌクレオカプシドタンパク質(N)に封入されたウイルスRNA があります(図1)。

図1.SARS-CoV-2コロナウイルスの抗原タンパク質
SARS-CoV-2ウイルスRBD タンパク質は、肺、心臓、動脈、腸、および腎臓などの複数の臓器の細胞にあるヒトアンジオテンシン変換酵素2(ACE-2)受容体に結合します。結合すると、ウイルスは細胞内に侵入し、複製・放出という感染サイクルを繰り返します。
これらのウイルスタンパク質はそれぞれ、免疫系が感染に対して生成する抗体の抗原となり得ます。最も早期に生成される抗体は、鼻腔および腸の粘膜組織で形成される免疫グロブリンA(IgA)、および体液性免疫グロブリンM(IgM)です。その後、体液性免疫グロブリンG(IgG)が生成され、疾患に対する持続的な免疫が得られます。3種類の免疫グロブリンは、すべて血清および血漿サンプル中で測定可能です。
SARS-CoV-2抗原に対するヒト免疫グロブリン検出のためのマルチプレックスアッセイ
COVID-19 患者の血清/血漿サンプルのSARS-CoV-2抗原に対する免疫グロブリン反応を測定することにより、SARS-CoV-2ウイルスに曝され、ある程度の免疫応答を示す人を同定できる可能性があります。研究者は、COVID-19の感染と回復過程における、このウイルスに対する免疫応答をさらに理解できるかもしれません。MILLIPLEX® SARS-CoV-2マルチプレックスアッセイにより、SARS-CoV-2抗原に対するヒト免疫グロブリンの検出が可能です。これらの選択可能な4プレックスパネルにより、研究者は以下のSARS-CoV-2ウイルス抗原のいずれか、またはすべてを選択することができます。
- スパイクタンパク質 サブユニット1(S1)
- スパイクタンパク質 サブユニット2(S2)
- 受容体結合ドメイン(RBD)
- ヌクレオカプシドタンパク質(N)
このマルチプレックスパネルの研究者による使用例を以下にご紹介します。
データ例
MILLIPLEX® SARS-CoV-2マルチプレックスキット(IgG、IgA、およびIgM)のそれぞれのプロトコルに従い、全4 種類のアナライト(S1、S2、RBD、およびN)について、EDTA血漿サンプルをデュプリケートでアッセイしました。サンプルは、SARS-CoV-2感染に対するPCRで陽性または陰性であった患者群から採取しました:COVID-19陽性人工呼吸器使用「Ventilated」(n=68)、COVID-19陽性人工呼吸器不使用「Not Ventilated」(n=115)、およびCOVID-19陰性「COVID-」(n=41)。1 アッセイ結果をグラフ(図2)で、各グループの各サンプルの個々のMFI 値をグループの平均値、+/-標準偏差(SD)、およびグループ間の有意性検定のp 値を用いて示します:****p<0.0001、***p<0.001、**p<0.01、*p<0.05。
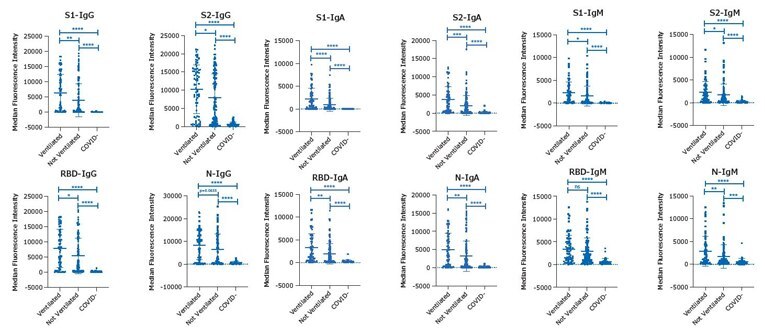
図2.MILLIPLEX® SARS-CoV-2キット(IgG、IgA、およびIgM)の全4 種類のアナライト(S1、S2、RBD、およびN)のEDTA血漿サンプルのデータ
ヒト血清および血漿中のSARS-CoV-2抗原タンパク質に対する抗体検出のためのMILLIPLEX® マルチプレックスアッセイに関する アプリケーションノート をご覧ください。
MILLIPLEX® SARS-CoV-2マルチプレックスキット
研究目的での使用に限定されます。診断目的では使用しないでください。
サイトカインストームとは?
免疫系が病原体または薬物などの他の免疫原性物質に過剰反応すると、過剰な炎症反応が起こり、免疫細胞からシグナル伝達分子が過剰に産生されることがあります。これをサイトカインストーム症候群(cytokine storm syndrome:CSS)もしくはサイトカイン放出症候群(cytokine release syndrome:CRS)と呼びます。急性もしくは全身性炎症により、肺に体液が滲出し、呼吸困難、多臓器不全に陥り、死に至ることもあります。
COVID-19(SARS-CoV-2)とサイトカインストーム
SARS-CoV-2ウイルスが肺に感染することによって、サイトカインストームは引き起こされます。過剰に産生された免疫細胞とそのシグナル伝達分子は、肺の局所的な炎症反応を起こし、呼吸困難や血中酸素濃度の低下を引き起こします。サイトカインストームは、重篤な臨床症状と患者の予後不良の原因となります。
COVID-19のサイトカインプロファイルに関するいくつかの初期の論文では、IL-2、IL-7、G-CSF、IP-10、MCP-1、MIP-1α、TNFαおよびFerritinのレベルが上昇することがわかっています。2 別の論文では、SARS-CoV-2の感染に伴い、IL-6も上昇することが発表されています。3 IL-6受容体(IL-6R)を標的とした免疫抑制性モノクローナル抗体療法のトシリズマブは、2020年3月26日にFDAにより、COVID-19肺炎を対象とした第III相臨床試験が承認されました。また、健常者と比較してCOVID-19患者は、IL-1β、IL- 1RA、IL-8、IL-9、IL-10、FGF-basic、GM-CSF、IFNγ、MIP-1β、PDGFおよびVEGFも上昇することが示されています。4
サイトカインストームに関連するCOVID-19研究のためのマルチプレックスアッセイ
サイトカインストームとCOVID-19の関係については、ヒトおよび霊長類の研究において、多くの研究がなされています。
ヒトの研究
COVID-19のサイトカインプロファイルに関する最近の文献では、M-CSF、IP-10、IL-1RA、IL-10、IL-15、IL-27、TNFαおよびIL-8のレベルの上昇は、サイトカインストームの予測因子であるか、より重篤な疾患と相関することがわかっています。5,6 プロファイリング研究では、IL-18、IP-10、MIGなどに加えて、IL-6、IL-8、TNFαおよびIL-10の血中濃度が重度のCOVID-19と関連していることが明らかになりました。7
霊長類の研究
SARS-CoV-2の研究は、アカゲザル(rhesus macaque)などの霊長類でも行われており、ワクチンや抗ウイルス薬/抗ウイルス療法を動物モデルで試験することができます。最近のNature誌の論文では、MILLIPLEX® 霊長類マルチプレックスアッセイを用いて、SARS-CoV-2に感染したマカクザルから複数の時点で採取した血清のサイトカインとケモカインのレベルの変化を解析したところ、IL-1RA、IL-6、IL-10、IL-15、MCP-1およびMIP-1βでは上昇し、TGFαでは減少することが示されました。8
MILLIPLEX® 霊長類サイトカイン/ケモカイン/成長因子パネルA により、血清、血漿、細胞/組織培養上清中の48種類の免疫因子を同時に定量することができます。自由にアナライトを組み合わせたり、プレミックスをカスタマイズしたり、38プレックスまたは48プレックスのプレミックスキットを選択することもできます。
MILLIPLEX®マルチプレックスアッセイを用いたCOVID-19に対する免疫応答の解明
MILLIPLEX® マルチプレックスアッセイにより、ヒトの免疫応答を理解する上で重要な多数のアナライトを同時に定量することができます。最大48プレックスを同時に測定できる ヒトサイトカイン/ケモカイン/成長因子パネルA は、実験時間とサンプル量を削減し、サイトカインストーム、敗血症およびその他の病状における、ある時点でのアナライトのプロファイルを解析することが可能です(図3)。
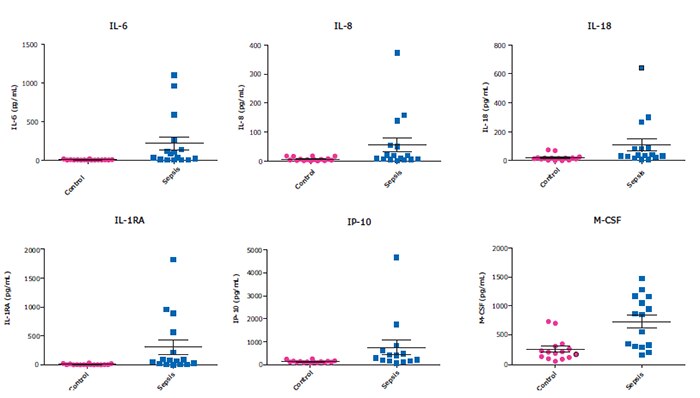
図3.健常者(n=20)と敗血症患者(n=16)の血清/血漿サンプル(BioIVT社、Discovery社およびBioChemed社より購入)を希釈せずに(25 µL/well)ヒトサイトカイン/ケモカイン/成長因子パネルA(カタログ番号:HCYTA-60K)で測定。ここでは、最近の研究論文でSARS-CoV-2のサイトカイン放出症候群(CRS)で増加すると言及されているアナライトの一部を示す。
関連のMILLIPLEX®キット
さまざまなMILLIPLEX® 可溶性タンパク質パネルとセルシグナリングキットは、抗ウイルスの免疫応答研究におけるダウンストリームのシグナル伝達経路の解明に役立ちます。これらは、ワクチン研究のための霊長類パネルを含む、多くの動物種の幅広いアナライトに対応しています。
研究目的での使用に限定されます。診断目的では使用しないでください。
新たなCOVID-19研究領域のためのマルチプレックスアッセイ
ACEとACE2は、血液凝固系、内皮細胞増殖、血管新生、補体経路、レニン・アンジオテンシン系(RAS)を制御する血漿カリクレイン・キニン系(KKS)で役割を果たします。9 カリクレイン、キニノゲンとともにキニンペプチドのブラジキニンはKKSを構成しています。ACE2はブラジキニンを減少させる機能があり、これが破壊されるとブラジキニンレベルが高くなり、全身性の炎症が増加する可能性があります。10 また、COVID-19では、CSSに加えて、RAS/KKSの破綻が重篤な合併症を引き起こす可能性があります。さらに、ブラジキニン受容体の活性化は、炎症を媒介し、サイトカインレベルの明確な上昇をもたらします。MILLIPLEX® マルチプレックスアッセイにより、COVID-19によって引き起こされるこれらのメカニズムを理解する上で重要な多数のアナライトを同時に定量することができます。これには、 Human Complement Expanded Panel 1 および Human Complement Panel 2の補体成分、レニン、カリクレイン-6、 Human Angiogenesis/Growth Factor Panel 1 および Human Angiogenesis Panel 2などが含まれます。
血液凝固障害は、COVID-19に関連した重篤な状態で、肺剖検におけるDダイマーの上昇と広範な微小血栓症によって示されます。11 血栓性合併症は、多臓器不全と高い死亡率に関連しています。CRPやフィブリノゲンなどの急性期タンパク質の高値は、このCOVID-19の重症度と相関があることが示されています。先に述べた疾患の特徴であるサイトカインレベルの上昇は、ICAM-1、VCAM-1、P-selectin、e-Selectinなどの接着分子のアップレギュレーションにつながる可能性があります。12 r MILLIPLEX® Human Cardiovascular Disease Panel 2により、ICAM-1、VCAM-1、D-Dimer、P-selectinを同時に定量し、この重篤な状態を研究することが可能です。
関連のMILLIPLEX®アッセイ
研究の飛躍的進歩は、信頼性のある高性能な製品とサービスによってもたらされます。MILLIPLEX® イムノアッセイは、Luminex® xMAP® テクノロジーに基づくマルチプレックスバイオマーカーアッセイの最大のポートフォリオです。一貫した高品質の結果が得られるため、研究者は時間、労力、コストを削減しながら最善の仕事をすることができます。
研究目的での使用に限定されます。診断目的では使用しないでください。
MILLIPLEX®キットを用いたCOVID-19オンデマンドウェビナー
COVID-19研究におけるMILLIPLEX® マルチプレックスアッセイの使用例についてオンデマンドウェビナーをご覧ください。これらのウェビナーでは、COVID-19患者の免疫応答を評価する方法と、疾患研究のワークフローにマルチプレックスイムノアッセイをうまく組み込む方法についてご紹介します。
- IgG Antibodies Against SARS-CoV-2 Correlate to Days from Symptom Onset in COVID-19 Positive Patients
- Keeping COVID-19 at Bay (only available in the U.S. and Canada)
- The Dynamics of SARS-CoV-2 Specific Antibody Responses in COVID-19 Patients (not available in the U.S. and Canada)
- Immune Responses in Severe COVID-19 Patients (not available in the U.S. and Canada)
- MILLIPLEX® Multiplex Immunoassays For Use in COVID-19 and Cytokine Storm Research
研究目的での使用に限定されます。診断目的では使用しないでください。
MILLIPLEX®製品を研究で使用した場合
論文で製品を引用する方法
論文発表の準備はできましたか?研究の進展のために製品をご利用いただきありがとうございます。
MILLIPLEX®アッセイキットの引用方法は以下のとおりです。
- 米国またはカナダにお住まいの方は、MilliporeSigmaをアッセイの提供元として記載してください。
- 米国またはカナダ以外の国にお住まいの方は、Merck KGaA, Darmstadt, Germanyをアッセイの提供元として記載してください。
- MILLIPLEX® キットの正式名称とカタログ番号を記載し、キットから使用したアナライトをリストアップしてください。
- 使用したサンプルの種類およびサンプルの希釈方法を記載してください。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?