高感度バイオマーカー検出プラットフォームにより加速する医薬品開発研究
医薬品開発研究には、多大な時間とリソースの投資が必要です。1分子カウント(SMC™)技術のような高感度バイオマーカー検出プラットフォームを用いて医薬品開発研究プログラムを加速できます。
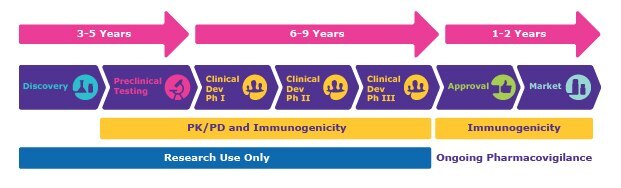
図1.典型的な医薬品開発研究プログラムのタイムライン。前臨床試験から第III相まではPK/PDおよび免疫原性試験が重要であり、承認後は免疫原性試験と継続的な医薬品安全性監視が行われる
図1に示すように、創薬のステージとしては、探索、前臨床試験、臨床開発/第I相、第II相、第III相、承認、上市があります。各ステージにおける検討事項の例を以下に示します:
探索
- ターゲットの同定
- 受容体結合
- 占有率
- ターゲット上の滞留時間
- 薬物ターゲット
前臨床試験
- 作用機序の証明
- 種差
- PK/PD
- 吸収、分布、代謝、排泄(ADME)
- 安全性/毒性
- 投与量の範囲
- ドラッグデリバリー(薬物送達)
- 有効性
- 臨床バリデーション
臨床開発/第I相~第III相
- 第0相マイクロドーズ
- 第I~III相試験
- 有効性
- 安全性
- ヒトPK
- 投与量選択
- バイオアベイラビリティ
承認/上市
- 第IV相
- 安全性
- 有効性
- 診断
- 病期分類
- 治療計画・モニタリング
- 予後
- 市販後調査
- 継続的な医薬品安全性監視

図2.薬物動態と薬力学による薬物およびエフェクター反応
PK/PD試験の最終目標は、適切な患者に適切な用量を投与することです。高感度検出プラットフォームによる完全なPK/PDプロファイリングについての詳細はこちら。
医薬品開発研究のための高感度検出プラットフォーム
高感度イムノアッセイ検出技術により、医薬品開発研究プログラムを加速できます。1分子カウント(SMC™)技術は、医薬品開発研究プログラムのニーズに応えるために設計されました。
例えば、以下のような特徴があります:
- 高感度プラットフォーム
- 迅速なサンプル測定時間
- 流路を使用しないシンプルな設計
- 低メンテナンス
- 自動システム自己診断機能 (ASSIST)
- オートメーション対応
- 業界最高水準のダイナミックレンジ(4~5 log)
- 統合データ解析ソフトウェア
- LIMSへ簡単にエクスポート
- 21 CFR Part11準拠ソフトウェア
- IQ/OQ/PQバリデーションサービス
- 研究目的での使用に限定されます。診断目的では使用しないでください。
医薬品開発研究で使用されているSMC™技術のケーススタディについては、以下のウェビナーをご覧ください。
関連ウェビナー
- Single Molecule Counting (SMC™) Technology Enables Acceleration of Drug Development Programs(米国とカナダのみで視聴可能)
- First Single Molecule Counting (SMC™) Application with microRNAs by a PCR Free Method(米国とカナダのみで視聴可能)
- Single Molecule Counting (SMC™) Technology for PK and ADA Applications
- High Sensitivity Measurement of Immunogenicity is Important for Patient Safety
ログインして続行
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?