ビタミンDと疾患の予防
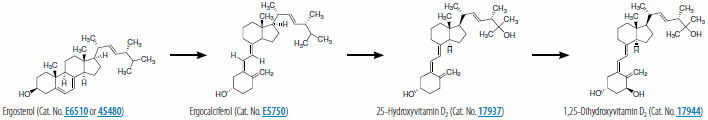
ビタミンD2(エルゴカルシフェロール)は、UVB照射による化学反応によって無脊椎動物、真菌、および植物のエルゴステロールから合成されますが、ビタミンD3(コレカルシフェロール)の合成は脊椎動物の皮膚のみで起こります。日光へのばく露に際し、UVB(280-315 nm)領域の光子は皮膚の表皮層と真皮層の細胞膜に存在する7-デヒドロコレステロールによって吸収されます。この反応によって7‐デヒドロコレステロールはプレコレカルシトロールという不安定な誘導体に変換され、これが速やかに転移反応を経てビタミンD3になります。ビタミンD結合タンパク質(DBP)はビタミンD3を細胞膜から細胞外空間内の皮膚毛細血管へ輸送する役割を担います。ビタミンD3は、羊毛のラノリンから抽出されたコレステロールから合成されます。抽出されたコレステロールは7-デヒドロコレステロールに変換されたのち、紫外線で処理されてビタミンD3が生成されます。ビタミンD2およびD3はいずれも、補強食品や栄養補助食品として商用に利用されています。
いずれのビタミンDも、生体内で2回の水酸化を受けて活性代謝産物の1,25‐ジヒドロキシビタミンD(1,25(OH)2D)を生成します。特にビタミンD3から合成される代謝物はカルシトリオール(1,25(OH)2D3)と呼ばれます。初回の水酸化は肝臓で起こります。肝臓では、CYP2R1(シトクロムP450、ファミリー2、サブファミリーR)によってコードされるD-25‐ヒドロキシラーゼが、ビタミンD3を25‐ヒドロキシビタミンD3(カルシジオールまたは25(OH)D3)に変換します。25‐ヒドロキシビタミンD3は、DBPの助けを借りて尿細管へと取り込まれます。尿細管では、CYP27Bによってコードされる25‐ヒドロキシビタミンD-1α‐ヒドロキシラーゼによる2回目の水酸化が起こり、1,25‐ジヒドロキシビタミンD3(1,25(OH)2D3)が生じます。この反応は、遊離型カルシウム、無機リン酸塩、および最終産物(1,25(OH)2D)によって阻害され、副甲状腺ホルモン(PTH)(25‐ヒドロキシビタミンD-1α‐ヒドロキシラーゼの調節因子)によって刺激されます。図1および2に、1,25‐ジヒドロキシビタミンD2および1,25‐ジヒドロキシビタミンD3の合成経路を示します。1,25(OH)2Dは、カルシウムの腸管輸送、腎臓のカルシウム吸収、骨の形成と維持、インスリン分泌、および血圧調節に関与します。これらの生理活性は、1,25(OH)2DがビタミンD受容体(VDR)と結合することによって起こります。この受容体は、リガンド依存性の転写因子で、レチノイドX受容体(RXR)とヘテロ二量体を形成し、これらの生理活性に関与する遺伝子の転写をもたらします。
腸内でのVDR-RXRヘテロ二量体の結合は、細胞内のカルシウムイオンを血流中に輸送するカルシウム結合タンパク質カルビンジンの転写を調節します。1,25(OH)2Dによるカルビンジン発現の調節は、インスリン分泌膵島細胞内の細胞内カルシウム流出を制御すると考えられています。1,25(OH)2Dは、骨芽細胞による骨形成と破骨細胞の維持にも重要な役割を果たしています。骨芽細胞では、VDR-RXRヘテロ二量体が受容体アクチベーターNF-κΒリガンド(RANKL)の発現を誘導します。RANKLのRANK受容体への結合によるシグナル伝達カスケードは細胞分化と破骨細胞の増殖をもたらします。副甲状腺では、1,25(OH)2DはPTH遺伝子転写の抑制、VDR濃度の調節、およびカルシウムに対する副甲状腺反応に関与します。ビタミンDの欠乏と高血圧との相関関係は、レニン-アンジオテンシン系の負の内分泌調節因子としての1,25(OH)2Dの役割に起因している可能性があります。実際に、VDRノックアウトマウスが高レベルのレニン発現とアンジオテンシン産生を示し、結果として高血圧症を発症したという実験結果が報告されています。
VDRは、これらの生理活性に関与するだけでなく、β‐カテニン(カドヘリン関連タンパク質)による成人表皮の毛包形成の誘導においても重要な役割を果たしています。Palmerらは、ケラチン14プロモーター(K14ΔNβ‐カテニンER)の制御下で安定化されたβ‐カテニンの4‐ヒドロキシ‐タモキシフェン(4OHT)誘導型を用いて構築したトランスジェニックマウスにおいて、ビタミンD類似体がβ‐カテニンにより誘導される毛包腫瘍形成を阻害することを明らかにしました。図3、A~Cに、ビタミンD類似体(EB1089)で処置したマウスと未処置のマウスの尾部の比較、および野生型とK14ΔNβ‐カテニンERトランスジェニックのマウスの染色尾部切片の比較を示します。Palmerらは、VDRの欠損状態ではβ‐カテニンが浸潤性基底細胞がんを誘導することも報告しています。図3のDおよびEに、β‐カテニンとVDRで標識付けされた毛包腫および基底細胞がんの染色済みヒト皮膚切片を示します。VDRは毛包の分化を促進してWntにより誘導される腫瘍形成を調節する、Wnt経路の転写エフェクターであるという研究結果が報告されています。この研究は、がん関連機序へのビタミンDの関与の理解の進展に繋がる最近の研究の一例です。
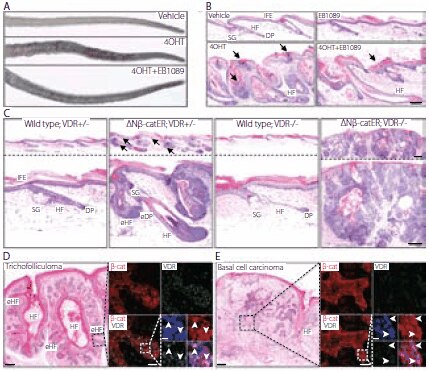
図3VDRはβ‐カテニンにより誘導される皮膚腫瘍を調節する。(A、B)K14ΔNβ‐カテニンER(D4)トランスジェニックマウスを、コントロール処理および4‐ヒドロキシ‐タモキシフェン(4OHT)、EB1089または4OHT+EB1089で21日間処置しました。(A)尾部の肉眼的外観。(B)ヘマトキシリン・エオジン(H&E)で染色した尾部皮膚切片。矢印は錯角化および角化層の増加を示します。(C)21日間の4OHT処置後の野生型とK14ΔNβ-カテニンER(D4)トランスジェニックのマウス、VDRに対するヘテロ接合性(+/–)またはホモ接合性欠損(–/–)の尾部切片 H&E 染色画像。矢印は異所性毛包形成を示します。eHF:異所性毛包、DP:皮膚乳頭、eDP:異所性皮膚乳頭。(D、E)ヒト毛包腫(D)および浸潤性基底細胞がん(E)。連続切片のH&E染色およびβ‐カテニン(赤色)およびVDR(緑色)免疫標識像。Hoescht共染色(青色)。免疫標識は、H&E染色切片の四角い領域に相当します。矢印は細胞核のβ‐カテニンおよびVDRを示します。スケールバー:100 μm(B~E)、50 μm(D、Eのインサート)、10 μm(D、EのHoescht染色インサート)。Copyright © Palmer, H.G. et al., PLoS ONE, 3(1), e1483.この画像は、Creative Commons Attribution Licenseの条項の下で配布されているオープンアクセス資料から入手したものです。
複数の研究が、ビタミンDの欠乏と結腸がん、前立腺がん、乳がん、卵巣がん、リンパ腫などの致死的がんとの関連性を示唆しています。母集団の25(OH)Dの平均循環レベルが約50 ng/mLまで増加すると、年間で約58,000例の乳がんの発症および約49,000例の大腸がん発症を予防できると言われています。しかし、有効な治療レベルでは高カルシウム血症を招くおそれがあることがら、用量の上限レベルは重要です。この情報は、観察研究と無作為化試験との組み合わせに基づいています。1,25(OH)2Dの産生は腎臓により厳密に調節されることから、がん予防に関するビタミンDのガイドラインは、1,25(OH)2Dよりも25(OH)Dの血中レベルに関するものが中心です。
日光ばく露や食事摂取によるビタミンDレベルの増強は、1,25(OH)2D産生の大きな上昇にはつながりませんが、25(OH)D濃度については有意な上昇をもたらします。25(OH)Dを水酸化できるのは腎臓だけではなく、皮膚、乳房、結腸、肺、および脳などさまざまな組織が25(OH)Dを1,25(OH)2Dに代謝する酵素活性を有します。血中の25(OH)Dのレベルが上昇すると十分な25(OH)D基質が供給されて、局所的に合成された1,25(OH)2Dを種々の組織型が使用できるようになるため、制御不能な細胞増殖や成熟、そして悪性の危険性から保護されることが示唆されています。
細胞増殖と成熟の制御は、ビタミンDの抗血管新生作用に左右される可能性があります。Mantellらは、「活性化された」内皮細胞への1,25(OH)2Dの処置が、血管新生過程における必須のステージ、つまり血管内皮細胞増殖因子(VEGF)が誘導する内皮細胞の発芽および伸長を有意に阻害するという研究結果を示しました。さらにin vivo試験では、1,25(OH)2D処置のないマウスで形成された腫瘍よりも1,25(OH)2D処置で生じた腫瘍のほうが、血管新生が少なかったことが示されています。
ビタミンDとがんに関するこれまでの研究の所見から、DINOMIT(disjunction(分離)、initiation(開始)、natural selection(自然選択)、overgrowth(異常増殖)、metastasis(転移)、involution(退縮)、およびtransition(移行))と呼ばれる新しいがん進行モデルが導出されました。このモデルは、細胞間情報伝達ががんの進行に寄与するというものです。この新しいモデルは、発がんモデルやがん幹細胞モデルとは大きく異なります。UCSDのCedric Garland氏は、「情報伝達喪失は、正常細胞の維持に不可欠な細胞間情報伝達が阻害されることにより、より攻撃的ながん細胞が増殖することを可能とするというモデルである」と述べています。ビタミンDのレベルが適切であれば、細胞は接着性を有し、適切な情報伝達を経て成熟した上皮細胞として機能しますが、ビタミンのレベルが不適切である場合は、細胞は接着性を失うとともに分化した細胞としての性質を失い、幹細胞のような状態に戻ります。Garland氏はさらに、「ビタミンDは、ビタミンD受容体を有する悪性腫瘍の細胞間結合部位を再構築することにより、がん過程の初期段階を停止させる可能性がある」と述べています。
本資料に示されているDINOMITモデルやその他の科学報告書は、ビタミンDの有益性を強調するものでありますが、疾患の予防に対するビタミンDの効果を完全に理解するにはさらに多くの研究や長期的な臨床試験が必要です。
関連製品
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?