3Dバイオプリンティング:組織および疾患モデルへの応用
はじめに
3次元(3D)バイオプリンティングは急速な発展を遂げており、生きた組織構造物の作製に非常に大きな可能性をもたらしています1,2。バイオプリンティングの最も一般的な形では、コンピュータ支援電動装置を使用して、生体適合性材料、生細胞、成長因子、タンパク質、核酸、薬物、および支持要素を交互積層法で精密な形状に堆積し、機能的および構造的に生体を模倣した組織構造物を作製します。
近年、3Dバイオプリンティングは組織および疾患モデルの分野で大幅に前進しており、創薬や治療用のスクリーニングを促進しています。一般に、バイオプリンティングは、押出法、インクジェット、レーザーアシスト、ステレオリソグラフィーなどの少数の主要な技術的方法の1つを利用します3。押出法によるバイオプリンティングでは、機械的または空気圧の力でノズルからバイオインクを分注して、連続的なフィラメントを形成します。現在、最も広く使用されているバイオプリンティング法である押出法によるバイオプリンティングは、比較的低速で分解能は低いものの、十分な細胞生存性を持つ高粘度のバイオインクから構造物を作製することができます。インクジェットによるバイオプリンティングでは、熱、圧電、音響的な力を利用して、液滴状のバイオインクを堆積します。この方法では作製の速度は速いものの、細胞の密度は低下します。通常、押出法によるバイオプリンティングでは高粘度のバイオインクが用いられるのに対して、インクジェットによるバイオプリンティングは低粘度のバイオインクを必要とします。レーザーアシストバイオプリンティングはノズルを用いない方法で、レーザーパルスを使用して供給側のスライドから受け側の基板にバイオインクを堆積させます。この方法では非常に粘性が高く、高密度に細胞化したバイオインクの堆積が可能ですが、細胞の生存率が低いという制限を受けます。最後に、ステレオリソグラフィーによるバイオプリンティングでは、精密に制御された光のパターンを利用して、垂直に移動可能な収集プラットフォーム上で1層ずつ感光性ポリマーを光重合させることで、要求される構造の3D構造物を形成します。ステレオリソグラフィーによるバイオプリンティングでは、他の方法と比較して高分解能が得られ、作製が高速になり、細胞生存性が向上します。
手法は異なるものの、ほとんどのバイオプリンティングの工程は次の類似した一連の手順からなります。(i)コンピュータ支援設計ソフトウェアを使用した3Dモデルの構築。(ii)バイオインクの開発または選択。通常は、用いる手法やバイオプリントされる特定の組織に応じて、1つ以上の適合する生体材料と生細胞を組み合わせたバイオインクを使用。(iii)ロボット制御のプログラムされたバイオプリンティング。プリンティング中またはプリンティング後に物理的または化学的な架橋形成を伴います。(iv)バイオプリントされた組織構造物の成熟。一般に、バイオプリントされて成熟した組織構造物は、生体組織工学および再生医療における用途のために個々に設計されます2。さらに最近では、3Dバイオプリンティング法を用いた機能性組織モデルの作製が、疾患モデル、創薬、個別化治療のためのスクリーニングで利用されています4。ここでは、バイオインクの選定について簡単に概説し、組織モデルのバイオファブリケーションにおける3Dバイオプリンティングの用途に関連する代表的な例を示します(図1)。
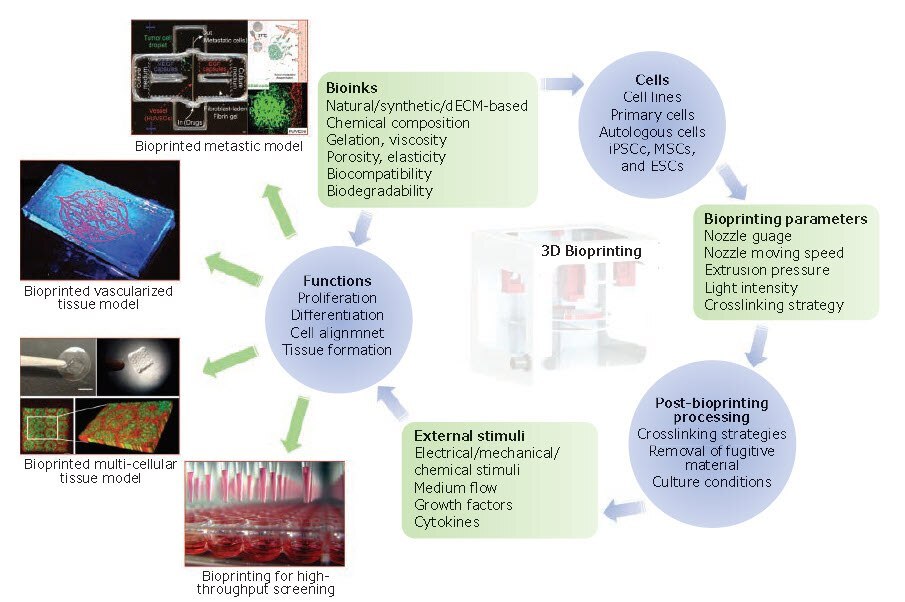
図13Dバイオプリンティングの基本構成要素および用途。バイオインク、バイオプリンティングのパラメータ、バイオプリンティング後の処理はすべて、細胞の生存性と機能性に影響を与え、さらにその後の細胞の増殖、分化、組織形成などの過程に影響します(図中の単語、hiPSCs (human induced pluripotent stem cells):ヒト人工多能性幹細胞、MSCs (mesenchymal stem cells):間葉系幹細胞、ESCs (embryonic stem cells):胚性幹細胞)。バイオプリントされた転移性モデルおよび灌流可能な血管化した組織は文献27および28より許可を得て転載。copyright 2019および2017 Wiley。バイオプリントされた肝臓モデルは文献18より許可を得て転載。copyright 2016 United States National Academy of Sciences。
バイオインクの開発および生体材料の選択
バイオインクは、3Dバイオプリンティングの最も重要な構成要素の1つです。バイオインクは基本的にハイドロゲル生体材料です。1つ以上の細胞タイプ、栄養、成長因子をさまざまな量で含有し、組織の細胞外マトリックス(ECM:extracellular matrix)を模倣し、埋め込まれた細胞の成長を助けます5。生物学的に妥当なバイオインクの設計は、3Dバイオプリンティングによる組織構造物の作製における非常に重要な課題の1つです。バイオインクは、埋め込まれた細胞を構造的、物理的、機械的に支えるだけではなく、組織の形態形成および恒常性のために必要な細胞の生存、増殖、分化に不可欠な生物学的および化学的な信号を与えるものでなければなりません。バイオインクとして適切な生体材料(または複数の生体材料の組合わせ)を選択することは、組織のバイオプリンティングを成功させる重要なステップであり、使用するバイオプリンティングの方法、関心のある組織、必要なプリンティング後の工程などの複数の要素に左右されます。一般に、理想的なバイオインクは以下の特長を持ちます。(i)印刷適性が高い。(ii)細胞に優しい方法で硬化できる。(iii)関心のある組織の構造的な一体性を維持するために適切な機械的強度を持つ。(iv)生体適合性および生分解性があり、毒性や免疫反応を誘発しない。(v)生きた細胞の接着、移動、増殖、分化などの活動を支援して促進するために、in vivoの微小環境を模倣する(図2A、B)。
これまでに、組織の3Dバイオプリンティングのためのバイオインクの調合に多数のハイドロゲル生体材料が使用されています(図2C)。その例として、コラーゲン、ゼラチン、アルギン酸、フィブリン、ヒアルロン酸、絹タンパク質、キトサン、脱細胞化ECM(dECM:decellularized ECM)などの天然由来の生体材料や、ポリエチレングリコール(PEG:poly(ethylene glycol))、ポリ(メタクリル酸ヒドロキシエチル)、ポリビニルアルコールなどの合成生体材料が挙げられます4。天然由来の材料は、生体適合性、分解の調節可能性、天然ECMとの本質的な類似から、生体材料として有利です。ただし、機械的強度が弱く、生産バッチ間で組成や性質のばらつきがあるという共通の欠点があります6。これに対して、合成生体材料は定義が非常に明確で再現可能であり、組成を調節することも可能です。さらに、生物学的に不活性で、非毒性かつ非免疫原性であるものも多くあります。合成生体材料の機械的性質、分解速度、組成は容易に制御することができます。ただし、合成材料には細胞の接着に適したサイトがない場合が多く、また天然ECMが持つ複雑さを持っていません7。したがって、これらの限界を克服し、天然ECMの化学的および物理的性質の両方を模倣する組織様の微小環境を設計するために、合成材料と天然の生体材料を組み合わせることが多々あります。例えば、4-arm PEG-テトラアクリラート(PEGTA:PEG-tetraacrylate)-ゼラチンメタクリロイル(GelMA:gelatin methacryloyl)および8-arm PEG-オクタアクリラート(PETOA:PEG-octaacrylate)-GelMAの複合バイオインクが、生体模倣性血管組織の3Dバイオプリンティングのために開発されています8,9。PEG誘導体をGelMAに付加することで、複雑な多層の中空構造のバイオプリンティングを容易にする適切なレオロジーおよびその他の機械的性質が得られます。
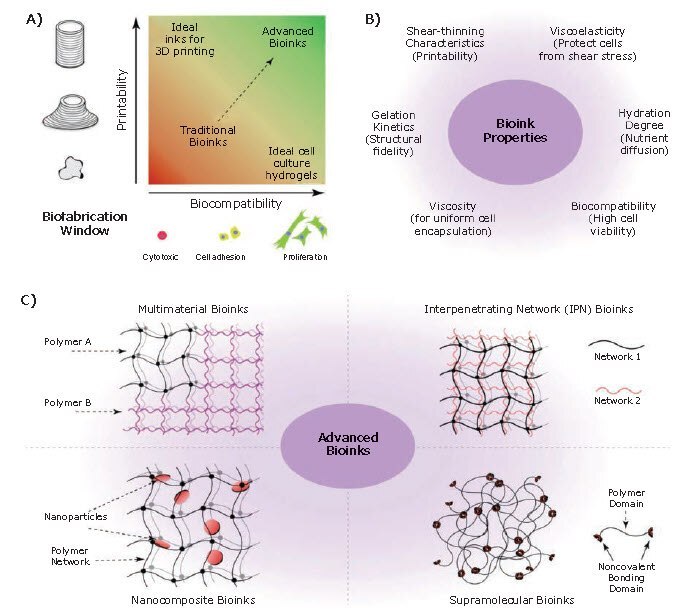
図23Dバイオプリンティングのためのバイオインク。A)バイオインクを設計するための合理的なアプローチでは、印刷適性と生体適合性の両方を考慮する必要があります。B)理想的なバイオインクの特性。C)先端的バイオインクの4つの主要な分類。文献5より許可を得て転載。copyright 2016 Springer Nature。
ただし、これらの複合ハイドロゲルでも、組織特有の機能を獲得するための生体を模倣した物理化学的特性を十分には持たない可能性があります。その結果、dECM由来ハイドロゲルがバイオインクとしてより使用されるようになっています。脱細胞化処理では、すべての細胞成分を除去し、ECMの構造成分と水溶性因子の多くが損なわれずに残るようにするため、機械的処理、化学的処理、酵素処理を組み合わせて用います。複数の研究で、dECMが元の天然ECM組織の生化学的組成を維持することが示されており、これが生物学的に妥当な組織を形成するときの細胞の表現型と機能性の維持に重要であることが実証されています。例えば、腎臓dECM由来のバイオインクを使用してバイオプリントされた腎構造物は、天然の腎組織が持つのと同等な生理学的特性を示します10。同様に、ペプシンで可溶化した心臓、脂肪、軟骨組織由来のdECM系バイオインクを使用した3Dバイオプリンティングでは、バイオプリントされたラット筋芽細胞、ヒト脂肪由来幹細胞、ヒト間葉系幹細胞がそれぞれの組織構造物で高い生存性および機能を示しています11。
バイオプリントされた組織/疾患モデルおよび薬物効果の探索における用途
空間的に制御された構造を持つバイオプリントされた組織構造物は、組織および疾患モデルのためのin vitroのツールとして重要であり、毒物学に関連性が高い用途があります。これらのモデルによって、特定の薬物の生化学的、遺伝学的、組織学的な影響を研究できるため、薬物動態学的、薬力学的、毒物学的な情報が得られます。本セクションでは、組織特有の機能、薬物代謝活性、薬物応答の研究における3Dバイオプリントされた組織および疾患モデルのいくつかの用途について検討します。薬物スクリーニング用途で使用される代表的なバイオプリント組織モデルを表1に示します。
心臓組織モデル
バイオプリンティングは、薬物試験の用途に向けた、生理学的に意味のある3D収縮性心臓組織を作製できる可能性があります。例えば、フィブリノゲン、ゼラチン、アプロチニン、グリセロール、ヒアルロン酸を含むフィブリン系バイオインクに封入されたラット一次心筋細胞がバイオプリントされ、in vitro培養において自発的で同期した収縮を示す心臓組織構造物が作製されています12。これらの構造物は、アドレナリン(エピネフリン)やカルバコールなどの既知の心毒性薬物に対する生理学的反応が評価されています。アドレナリン(200 nM)は拍動数を1分あたり80拍から110拍に増加させ、カルバコール(10 µM)は1分あたり40拍に減少させることが観測されています。血管は、心臓を含む組織への栄養、酸素、薬物の輸送および排出に重要な役割を果たします。そのため、最近のもう1つの例では、ヒト臍帯静脈内皮細胞(HUVEC:umbilical vein endothelial cell)充填アルギン酸/GelMAブレンドバイオインクを使用した押出法によるバイオプリンティングで、内皮化した微細繊維状の3D足場(スキャフォールド)が作製されています(図3A、B)。さらに、新生仔ラット心筋細胞またはiPSC由来心筋細胞をこれに播種することで、自発的に同期した収縮を行う能力のある内皮化した心筋組織が作製されています(図3C)13。その後、この組織モデルはマイクロフルイディクスバイオリアクターに統合され、抗がん剤であるドキソルビシンの毒性の用量依存性および時間依存性の研究に用いられています。ドキソルビシンに6日間暴露すると、HUVECによるフォン・ヴィレブランド因子(vWF:von Willebrand factor)の分泌が減少するとともに、心筋細胞の拍動数が減少しました(図3D、E)。
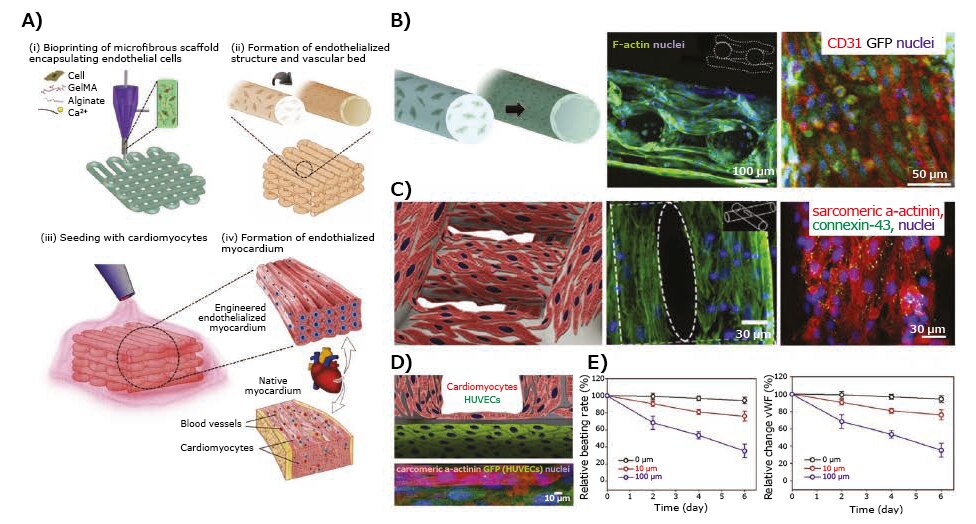
図3薬物試験における3Dバイオプリント組織モデルの応用—3Dバイオプリントされた内皮化心筋モデル。A)内皮化心筋組織モデルの作製手順を示す概略図。B)周縁部の内皮の融合層へのバイオプリントされた微細繊維中のHUVECの集合を示す概略図と、3層の足場の断面とHUVEC間の密着を示す共焦点蛍光画像。C)新生仔ラット心筋細胞を播種した足場を示す概略図。微細繊維表面の心筋細胞の分布を示すF-アクチン染色と、筋節のα-アクチニンおよびコネキシン-43の発現の免疫蛍光染色。D)内皮化した心筋組織を示す概略図および高分解能共焦点蛍光顕微鏡写真。E)異なる用量のドキソルビシンで処理した際の内皮化した心筋組織の相対的な拍動および内皮細胞により発現されるvWFのレベル。文献13より許可を得て転載。copyright 2016 Elsevier。
腎臓組織モデル
ヒトの腎臓は1日に約180 Lの血漿をろ過し、尿細管を通して水および溶質を再吸収し、血液から老廃物を除去します14。そのため、薬物や毒素による損傷の影響を受けやすくなっています。バイオプリンティングは、腎臓のろ過、再吸収、分泌の機能を示す組織または構成要素(尿細管など)を作製する有望な方法です。Homanらは、押出法によるバイオプリンティングで近位尿細管をバイオプリントしました。最初にPluronic F127およびトロンビンからなる犠牲的なバイオインクがゼラチン-フィブリノゲン-トランスグルタミナーゼECM上にプリントされ、次にPluronic F127を除去することで、架橋されたECM内に中空の細管が作製されました(図4A、B)15。その後、この細管に近位尿細管上皮細胞が播種され、管腔を通した連続的な培地灌流の下で成熟されました(図4C)。灌流可能な近位尿細管は上皮のような形状を示し、シクロスポリンAで処理すると用量依存的に崩壊しました(図4D)。同じグループは後に、彼らの元のECMと一過性のバイオインクに若干の修正を加えて使用して、近位尿細管と血管性の導管が近接してECMに埋め込まれた3D血管化近位尿細管モデルのバイオプリンティングを報告しています(図4E)16。近位および血管性の導管に、それぞれ近位尿細管上皮細胞および糸球体毛細血管内皮細胞が播種されました(図4F)。蛍光標識化されたアルブミンおよびイヌリンを使用して生体高分子の取り込みが研究され、アルブミンが選択的に再吸収されることが示されました。さらに、ダパグリフロジンを含む場合と含まない場合の高グルコース(400 mg glucose/dL)培地と通常のグルコース(100 mg glucose/dL)培地を近位尿細管に循環し、グルコースの再吸収と内皮細胞の機能障害の両方を観測することで、上皮-内皮のクロストークが研究されました。
肝臓組織モデル
肝毒性は、依然として多くの薬物が開発後期に中止となる主な理由であり17、そのため、創薬において肝臓の薬物毒性研究が極めて重要になっています。この目的で、3Dバイオプリンティングは、薬物代謝とともに、グルコースおよび脂質の代謝も高い信頼性で再現する肝臓組織モデルを作製するために使用されています。この一例として、GelMAおよびメタクリル酸グリシジル-ヒアルロン酸を使用した生理学的に有用な構造体に、パターン化したヒト人工多能性幹細胞(hiPSC)由来肝細胞、HUVEC、および脂肪由来幹細胞を持つ3D肝小葉モデルを開発するために、デジタル光加工に基づくステレオリソグラフィーによるバイオプリンティングが使用されています18。この著者らは、バイオプリントした3D肝モデル中のhiPSC由来肝前駆細胞(hiPSC-HPC:hiPSC-derived hepatic progenitor cell)における薬物代謝に関わる異なる肝マーカー遺伝子および酵素の発現を検討しました。5つのシトクロムP450(CYP1A2、CYP2B6、CYP2C9、CYP2C19、およびCYP3A4)の中で、最もよく見られるCYPであるCYP3A4の発現が、hiPSC-HPCにおいて有意に増加していることが示されました。現在使用されている薬物の約半数がCYP3A4によって代謝されると推測されていることから18、このモデル系が有望であると言えます。彼らはさらに肝毒性を持つ可能性が有る抗生物質であるリファンピシンを評価し、未処理の対照と比較して、リファンピシンが3Dバイオプリント肝モデルのhiPSC-HPCにおいてCYP3A4、CYP2C9、およびCYP2C19の発現を有意に増加させることを示しました。Nguyenらによる別の研究19では、一次ヒト実質細胞(100%肝細胞ペースト、コンパクションにより生成)および非実質細胞(NovoGelハイドロゲル中のHUVECおよび肝星状細胞)を使用したマイクロ押出成形によって肝臓組織モデルが作製されています。既知の肝毒物であるトロバフロキサシンに対する反応がレボフロキサシンと比較して研究され、トロバフロキサシンが臨床的に使用し得る用量(≤4 µM)で用量依存的に有意な毒性を引き起こすことが明らかにされました。同様に、HepG2細胞を充填したMatrigelを使用した押出法でバイオプリントされた肝臓モデルをマイクロフルイディクスシステムで用いて、抗放射線プロドラッグのアミフォスチンの代謝が分析されています20。さらに、GelMAバイオインクを用いて、ヒトHepG2/C3Aスフェロイドのバイオリアクターへの直接の3Dバイオプリンティングが成功しています(図5A、B)21。肝スフェロイドをバイオプリントした肝臓オンチッププラットフォームが培地灌流の下で培養され、バイオプリントされた構造物内の肝細胞におけるアルブミン、α1アンチトリプシン(A1AT:alpha-1 antitrypsin)、トランスフェリン、セルロプラスミンの分泌とともに、サイトケラチン18、多剤耐性関連タンパク質2(MRP-2:multi-drug resistance-associated protein 2)、およびタイトジャンクション構成タンパク質ZO-1の発現が分析されました(図5C)。さらに、アセトアミノフェン(APAP:acetaminophen)の毒性が評価され(図5D)、このモデルの薬物毒性試験への適用性が示されました。
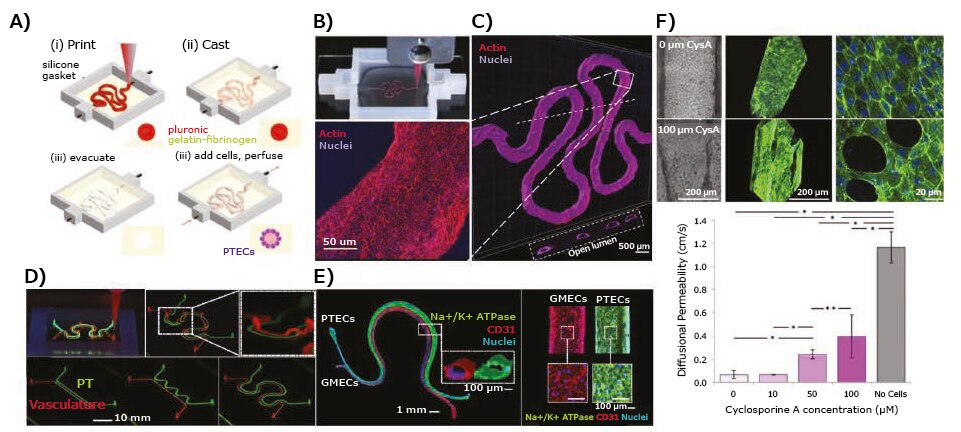
図4薬物試験における3Dバイオプリント組織モデルの応用—3Dバイオプリントされた回旋状近位尿細管モデル。A)3D近位尿細管の作製の異なるステップの概略図。B)近位尿細管のバイオプリンティング工程を示す写真(Pluronic F127犠牲テンプレート)。C)近位尿細管上皮細胞の融合層が集合した、バイオプリントされた回旋状近位尿細管の共焦点顕微鏡で得られた3Dレンダリング画像。D)フルオレセインイソチオシアネート(FITC:fluorescein isothiocyanate)-デキストラン(70 kDa)の拡散透過性の定量化で示された、シクロスポリンAに引き起こされた上皮バリア機能の崩壊。E)単純および複雑なバイオプリントされた血管化近位尿細管(3D VasPT:vascularized proximal tubule)モデル。F)近位尿細管に上皮細胞、血管に内皮細胞を含有する3D VasPTの共焦点画像。Creative Commons Attribution License 4.0の下に転載。文献15および16より許可を得て転載。copyright 2016 Natureおよび2019 United States National Academy of Sciences。
腸組織モデル
腸は、薬物が再吸収される主要な臓器の1つです。最近、押出法によるバイオプリンティングで、成体ヒト腸筋線維芽細胞を使用した中間層と、熱応答性NovoGelに懸濁させた成体ヒト腸上皮細胞を使用した上皮層の二重層腸組織モデルが作製されました22。この腸組織構造物は、E-カドヘリン、ZO-1などのタイトジャンクション構成タンパク質や機能性CYP450酵素を発現し、分極上皮細胞モデルになることが示されました。ルシファーイエロー、ミトキサントロン、ジゴキシン、プロプラノロール、およびトポテカンを使用した透過性の研究が実施されました。さらに、非ステロイド性抗炎症薬であるインドメタシンの毒性が研究され、バイオプリントされた腸組織のバリア機能が用量依存的に低下することが明らかになりました。
腫瘍モデル
正常な組織に加えて、バイオプリンティングは、ネイティブな腫瘍微小環境をより正確に再現する腫瘍組織モデルの作製にも有望であることが示されています。このような微小環境は、腫瘍細胞の増殖、転移性の播種、および医薬品に対する反応において極めて重要です。グリオーマ(神経膠腫)幹細胞を充填した多孔性のアルギン酸/ゼラチン/フィブリノゲンのバイオインクを使用して、押出法で3Dバイオプリントされたグリオーマモデルが確立されています23。このグリオーマモデルを使用した薬物感受性の研究では、単層培養と比較して、テモゾロミドに対する耐性が400~1600 µg mL-1の濃度で増加することが示されています。さらに最近、2ステップ押出法によるミニ脳のバイオプリンティングが報告されています。最初にマウスマクロファージ細胞を使用して、空洞のあるより大型の脳組織をバイオプリントし、次に、その空洞にマウスグリオブラストーマ細胞が充填されました。いずれの細胞もGelMA/ゼラチンブレンドにカプセル化されたバイオインクとして用いられました24。グリオブラストーマ細胞はマクロファージを活発に補填し、グリオブラストーマ関連のマクロファージに特異的な表現型に極性化しました。グリオブラストーマの一般的な化学療法剤であるカルムスチンと、AS1517499(Stat6阻害剤)およびBLZ945(コロニー刺激因子1受容体(Csf-1r:colony stimulating factor 1 receptor)の阻害剤)の2種類の免疫調整薬の効果が調査されました。さらに、ゼラチン/アルギン酸/フィブリノゲンに封入されたHeLa細胞を使用して、子宮頸がんの3D腫瘍モデルがバイオプリントされ、平面培養と比較するとパクリタキセルに対する化学療法抵抗性が増加することが示されました25。別の研究では、Matrigel上に微細パターンを形成したOVCAR-5ヒト卵巣がん細胞およびMRC-5線維芽細胞を使用して、マイクロバルブ細胞堆積(すなわちインクジェットによるバイオプリンティング)により3D卵巣がんモデルが作製されました26。OVCAR-5およびMRC-5細胞は、ハイスループットおよび再現可能な方法で、空間的に制御された微小環境でデュアル吐出ヘッドを使用して同時に吐出されました。Matrigel上に重ねられたOVCAR-5細胞は、サイズが約100~500 µm2の多細胞性腺房を自発的に形成し、15日間の培養期間にわたって不均一性が徐々に増加しました。
また、Mengらは27、肺腫瘍細胞(A549細胞)、HUVECで被覆された血管性の導管、および3Dバイオプリントされたコア・シェル型カプセルからの生化学的シグナルを統合することで、転移性播種を模倣した血管新生腫瘍モデルの3Dバイオプリンティングについて報告しています。成長因子を担持したGelMAハイドロゲルがコアとして、金ナノロッドで修飾された乳酸-グリコール酸共重合体(PLGA:poly(lactic-co-glycolic acid))フィルムがシェルとして選択され、線維芽細胞を充填したフィブリンハイドロゲルマトリックスが腫瘍間質の主成分の役割を果たしました。カプセルから動的に放出される上皮増殖因子および血管内皮増殖因子の勾配を利用して、腫瘍細胞の周囲のマトリックスへの侵襲および脈管構造への侵入が研究されました。さらに、EGF4KDELおよびCD22KDELの2種類のイムノトキシンリガンド特異的毒素の力価および標的化が研究されました。
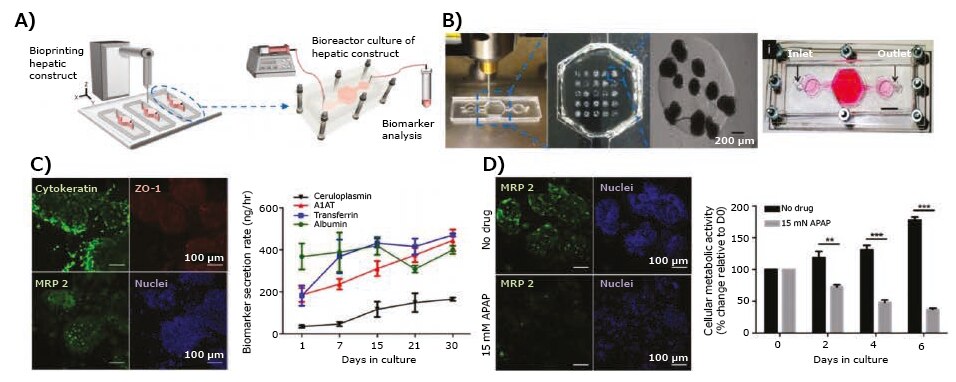
図53Dバイオプリント肝臓モデル。A)バイオプリンターおよびバイオマーカー分析モジュールと統合された肝バイオリアクター培養プラットフォームの概略図。B)バイオリアクター内にドットアレイとして直接バイオプリントされたGelMAハイドロゲル系肝構造物、および組み立てられたバイオリアクターの上面図(スケールバーは1 mm)。C)サイトケラチン18、ZO-1、MRP-2、および核について染色された、バイオプリントされたHepG2/C3Aスフェロイドを示す共焦点画像、ならびに肝バイオマーカーのアルブミン、A1AT、およびセルロプラスミンのHepG2/C3Aスフェロイドによる分泌の速度。D)MRP2の発現を示す共焦点画像および用量依存的なAPAP誘発肝毒性の影響を受ける肝スフェロイドの測定された代謝活性。文献21より許可を得て転載。copyright 2016 IOP publishing。
結論
近年、in vitroの薬物試験のために3Dバイオプリントされた組織モデルの使用が大幅に進歩しています。これらの組織モデルは再現性の向上が期待できることが示されており、自動化されたバイオプリンティングの運用により創薬コストが削減されることが予想されます。別の利点として、これらバイオプリントされた組織モデルは、学術研究機関の研究室と製薬会社の両方で薬物試験のための動物の使用を削減できるということが挙げられます。ただし、速度および分解能を改善する必要性、組織や患者特異的な細胞の適用可能性、および組織モデルの適切な血管化の必要性など、多くの課題がまだ残されています。さらに、現時点では適用可能な生体材料が限られています。したがって、機能性組織構造物の作製を改善し、薬物試験の用途を促進するために、新しいバイオインクが早急に必要とされています。
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?