多機能性ブロックコポリマーによるスマート核酸医薬デリバリー
はじめに
ポリマー材料は、過去20年以上にわたり、アンチセンス核酸(ASO:antisense oligonucleotide)やsiRNA(small interfering RNA)などの核酸医薬に対するデリバリーシステムとして研究されてきました1,2。ポリマー材料が核酸医薬デリバリーに用いられるようになったのは、水溶液中でカチオン性ポリマーがアニオン性のオリゴヌクレオチドと静電的に会合し、ポリイオンコンプレックス(PIC:polyion complex)またはポリプレックスと呼ばれるナノ粒子を形成するためです。PICは、酵素による分解からオリゴヌクレオチドを保護し、正に帯電したPIC表面が負に帯電した細胞膜に吸着するため、細胞への取り込み(または吸着性エンドサイトーシス)を促進します。重要な点は、構成要素のカチオン性ポリマーを化学的に修飾することで、PICのデリバリー能を大きく改善できることです。これを受けてポリマー材料の研究者達は、生体内環境に応答する化学結合などに着目し、多様なポリマー材料を設計してきました3。本稿では、オリゴヌクレオチドを内包したPICの主な特徴を説明すると共に、生体内環境に応答あるいは適合する「スマートオリゴヌクレオチドデリバリー」を実現する材料技術を紹介します。
オリゴヌクレオチドとカチオン性ポリマーによるPIC形成
ポリ(L-リジン)(PLys:poly(L-lysine))は、オリゴヌクレオチド内包PICを調製するために最も多く使われているカチオン性ポリマーの1つです。その理由として、生分解性を有すること、および側鎖の一級アミンが容易に化学修飾できることの2つが挙げられます。重合度(DP:degree of polymerization)が約40のPLysは、電荷がほぼ等価になる混合比(すなわちPLys中の[NH3+]とオリゴヌクレオチド中の[PO3-]のモル比が約1:1の場合)で、電荷中和によりオリゴヌクレオチドと会合してPICを形成します4。PLysを少し多めに加えると正に帯電したPICが得られ、細胞培養条件下での吸着性エンドサイトーシスに有利になります。ただし、正に帯電したナノ粒子は非特異的なタンパク質吸着を起こし、大きな凝集体を形成する場合が多くみられます。このような凝集体形成を避けるために、非イオン性かつ親水性のポリエチレングリコール(PEG:poly(ethylene glycol))がPLys(またはPIC表面)にコンジュゲーションされます5。PEGとPLysのジブロックコポリマー(PEG-PLys)は、アミン末端を有するPEG(PEG-NH2)をマクロ開始剤として使用したLys(Z)のN-カルボキシ無水物の開環重合、およびZ基の脱保護により合成されます7。PIC表面に形成されたPEG層は、立体反発を通じてPICを安定化し、アルブミンのような生体高分子の吸着やPIC同士の凝集作用を抑制します6。
筆者らの近年の研究を通じて、一本鎖RNA(ssRNA:single-stranded RNA)または二本鎖RNA(dsRNA:double-stranded RNA)とPEG-PLysのPIC形成は、二段階の会合挙動を示すことがわかってきました8。第1の会合は、最小の電荷中和単位でのPIC(またはユニットPIC)の形成であり、第2の会合は、ユニットPICの多分子集合によるミセル型あるいはベシクル型PICの形成です(図1A)。ssRNA(21量体)およびPEG-PLys(PEGの分子量(MW:molecular weight):2,000~42,000、PLysのDP:約40)の組合せでは、濃度が0.01 mg/mL未満において流体力学的径(DH)が10 nmのユニットPICが生成しました。これに対して、濃度が臨界会合濃度(CAC:critical association concentration)の約0.01 mg/mLを超えると、図1Bに示すように、40 nmのPIC、すなわちミセル型PICが観測されました。このような濃度に応答したサイズ上昇は、両親媒性ポリマーがミセルを形成する会合挙動によく似ています7。一方、dsRNA(21量体/21量体)とPEG-PLysとの間では、第2の会合(または多分子会合体)は観測されませんでした。0.1~10 mg/mLの広い濃度範囲で、DHが10 nmとなるユニットPICが観測されました(図1B)。ssRNAとdsRNAの間でPICの形成挙動が異なるのは、両者の剛性の違いで説明されます。dsRNAは持続長が60 nmであることから剛性の円柱状分子とみなされます。そのため、多分子会合に伴うエントロピー利得が減少することで、ユニットPICの多分子会合が妨げられていると考えられます8。

図1A)ssRNA(またはASO)およびdsRNA(またはsiRNA)の間で異なるPIC形成挙動の概略図。B)ssRNAまたはdsRNAとPEG-PLys(PEGのMW:12,000、PLysのDP:約40)から調製されたPICの流体力学径の変化。濃度の関数としてプロット。文献8より許可を得て転載。copyright 2016 Wiley。
上述のミセル型PICとユニットPICは、それぞれの特徴に基づいて、いずれも核酸医薬デリバリーに使用することができます。過去の多くの研究ではミセル型PICが注目されてきましたが、筆者らは最近、難治がんへの核酸医薬デリバリーに向けてユニットPICの大きな可能性を示しました。2分岐の長鎖PEGとPLysからなるY字型ポリマー(PEGのMW:2 x 37 kDa、PLysのDP:約20)を設計することで、1分子の核酸医薬(siRNAまたはASO)のみを内包する約18 nmのユニットPICが形成されました。このユニットPICは、マウスを用いて作製された線維性の膵がんモデルやヒト患者由来の脳腫瘍モデルに効率良く核酸医薬をデリバリーできました。その理由は、既存のナノ粒子製剤(約100 nm)と比べ、ユニットPICはサイズが非常に小さいことから、腫瘍組織への浸透性に優れているためと考えられます9,10。また、核酸医薬デリバリーにおいて重要なポリマー設計指針の1つとして、PICの安定性の調節が挙げられます。上で説明したように、多分子会合体としてのPICは、希釈条件下(またはCAC未満の濃度)で、ユニットPICに解離します。したがって、ミセル型PICが生体内(あるいは希釈環境下)で解離することを防ぐためには、追加の安定化が必要になります。その一方で、最終的には標的細胞の細胞質で、ミセル型PICは内包している核酸医薬を放出する必要があります。そのため、ミセル型PICを可逆的に安定化するポリマー材料の設計は、当該研究分野の主な課題の1つです。以下にその具体例を紹介します。
ミセル型PICの可逆的安定化に向けたPEG-PLysの化学修飾
可逆的な安定性を持つミセル型PICを創出するために、生体内環境に応答する化学結合がポリマー材料に組み込まれています。例えば、PEG-PLysのPLys側鎖にチオール基を導入することで、コアにジスルフィド架橋を有するミセル型PICが調製されます。このジスルフィド架橋ミセルは、血流のような非還元環境では比較的安定ですが、還元性の細胞質ではジスルフィド結合が開裂するため不安定になり、ミセルの解離を通じて核酸医薬を放出することができます。このチオール化PEG-PLysは、3-(2-ピリジルジチオ)プロピオン酸スクシンイミジル(SPDP)11–13、ジメチル-3,3'-ジチオビスプロピオンイミダート(DTBP)14、または2-イミノチオラン(IT)13,14をPEG-PLysと反応させることで合成されます(図2A)。
SPDPを用いてPLysの側鎖のうち10~30%にチオール基が導入されたPEG-PLys(PEG-PLys(MP))を、緩衝溶液中で一本鎖DNA(またはASO)と混合することで、ミセル型PICが形成されます。その後、空気酸化によりミセルコアにジスルフィド架橋が導入されます。ジスルフィド架橋ミセルはDHが40 nmで、架橋がないミセルと比較して、非還元的な希釈条件下で高い安定性を示します。一方、細胞質を模倣した還元条件(1 mMグルタチオン)の下では、内包していたASOを放出します12。
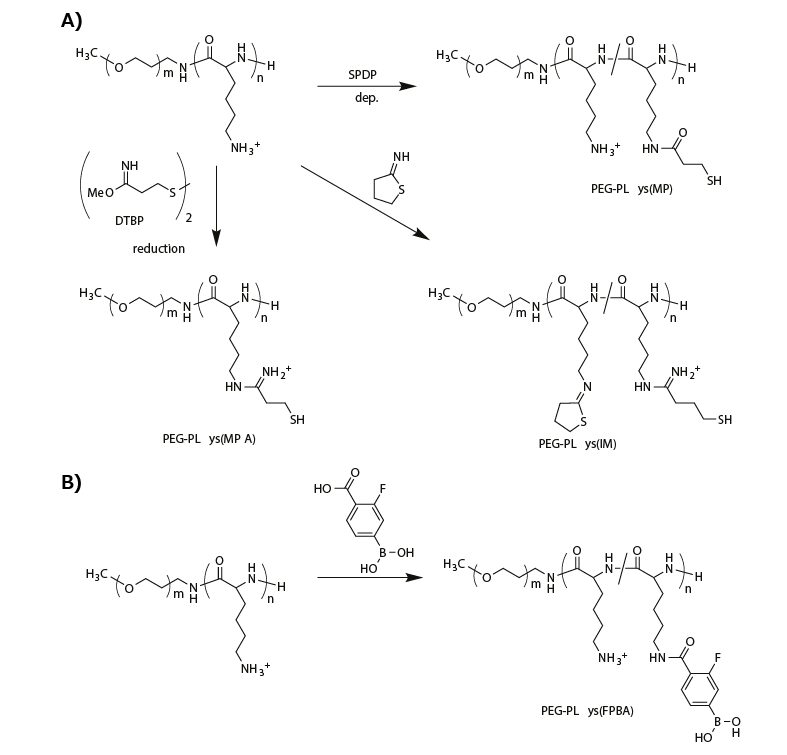
図2生体環境応答性を持つミセル型PICを調製するためのPEG-PLysの化学修飾。A)ジスルフィド架橋ミセルを調製するための一連のPEG-PLysのチオール化。B)ATP応答性ミセルを作製するためのフェニルボロン酸によるPEG-PLysの修飾。
siRNAを内包したミセル型PICについても、同様の架橋法が研究されています。剛性の高いsiRNAを内包したミセル型PICは、ASOを内包したミセル型PICよりも不安定だと予想されます。したがって、より多くのチオール基または追加の安定化構造が必要と考えられます。これを実現するために、SPDPの代わりにDTBPがPEG-PLysのチオール化に使用されました。DTBPを用いることで、正に帯電したアミジン基とチオール基が同時に導入されます(PEG-PLys(MPA))(図2A)。この方法により、高いチオール基導入率においても、PLys鎖の正電荷が維持されます。これに対して、ITでPEG-PLysを修飾した場合は、PLys鎖に環状イミノチオラン構造、アミジン基、およびチオール基が導入されます(PEG-PLys(IM))(図2A)。この環状イミノチオラン構造は、疎水性相互作用あるいは双極子相互作用を介して、siRNAを内包したミセル型PICの安定性を大幅に改善しました。実際に、PEG-PLys(IM)から調製されたミセル型PICは、PEG-PLys(MPA)から調製されたものよりも、静脈投与後の血中滞留時間が長いことが示されています14。
別の興味深い方法として、siRNAを直接、可逆的にPICのコアにコンジュゲーションする方法があります。四価の3-フルオロフェニルボロン酸(FPBA)は、生理的中性のpHで、cis-ジオール部分とフェニルボロン酸エステル結合を形成します15。これにより、FPBAで修飾されたPLysの側鎖(図2B)が、siRNAの両3’末端のリボース環とコンジュゲーションすることが可能になります16。重要な点として、この共有結合は可逆的であり、アデノシン三リン酸(ATP)などの高濃度cis-ジオール化合物の存在下で交換反応が生じることが挙げられます。実際に、ミセル型PICをPEG-PLys(FPBA)とsiRNAから調製すると、ミセルコアに内包されているsiRNAは、フェニルボロン酸エステルを介してPLys鎖とコンジュゲーションし、架橋コアを形成します。FPBA架橋ミセルは、低いATP濃度(< 0.3 mM、細胞外環境を模倣)では安定でしたが、高濃度のATP(約3 mM、細胞質条件を模倣)の存在下で解離することが確認されました。したがって、PEG-PLys(FPBA)を使用した可逆的なミセル安定化も可能です。
標的指向性核酸医薬デリバリーに向けたPEG-PLysの化学修飾
ミセル表面のPEG層は、非特異的なタンパク質の吸着を抑制することができますが、同時に内包している核酸医薬の吸着性エンドサイトーシス(または細胞への取り込み)を阻害する可能性があります。この欠点を克服するために、ミセル表面のリガンド分子修飾が研究されています17。すなわち、標的の細胞表面で過剰発現している特定のタンパク質または糖と特異的に結合する低分子、ペプチド、あるいは抗体などをリガンド分子として、ミセルの表面に導入する方法論です。重要な点は、ミセル表面に複数のリガンド分子を導入することで、ミセル型PICと標的の細胞表面との間で多点結合が可能になり、単分子結合と比較して、結合親和性が大幅に増幅されることです18。
多様ながん細胞および腫瘍組織の血管内皮細胞の表面で過剰発現しているαVβ3およびαVβ5インテグリンを標的とするために、環状RGDペプチド(cRGD)リガンドをミセル表面(またはPEG鎖の末端)に導入することができます。cRGDペプチドは、PEG末端に導入されたホルミル基とcRGDペプチド末端のシステインとの間のチアゾリジン環形成によって導入可能です(図3A)19。cRGDを搭載したミセル型PICは、培養子宮頸がん細胞におけるsiRNAの取り込み効率を改善することが確認されています20。さらに、皮下移植子宮頸がんモデルマウスに投与されたcRGD修飾ミセルは、cRGD未修飾のミセルと比較して、siRNAの腫瘍集積効率を大幅に増加させ、有意な抗がん活性をもたらすことに成功しています20,21。
また、PEG末端にアジド(N3)基を導入することで、銅触媒フリーのクリックケミストリーを介してヒト組織因子に対する抗体断片(抗TF Fab')リガンドもミセル表面に修飾できます(図3A)。TFは、膵がんやがん周辺の線維芽細胞などの多様ながん細胞および炎症性組織で過剰発現しています。したがって、抗TF Fab'は、がんおよびがん関連間質組織の標的化に利用することができます22。抗TF Fab'で修飾したミセルは、単層およびスフェロイドの両培養条件下で、TFを過剰発現している膵がん細胞に強く吸着することが示されています。さらに、抗TF Fab'で修飾したsiRNA内包ミセルは、皮下移植膵がんモデルにおいて、標的遺伝子の発現を有意に抑制しました23。
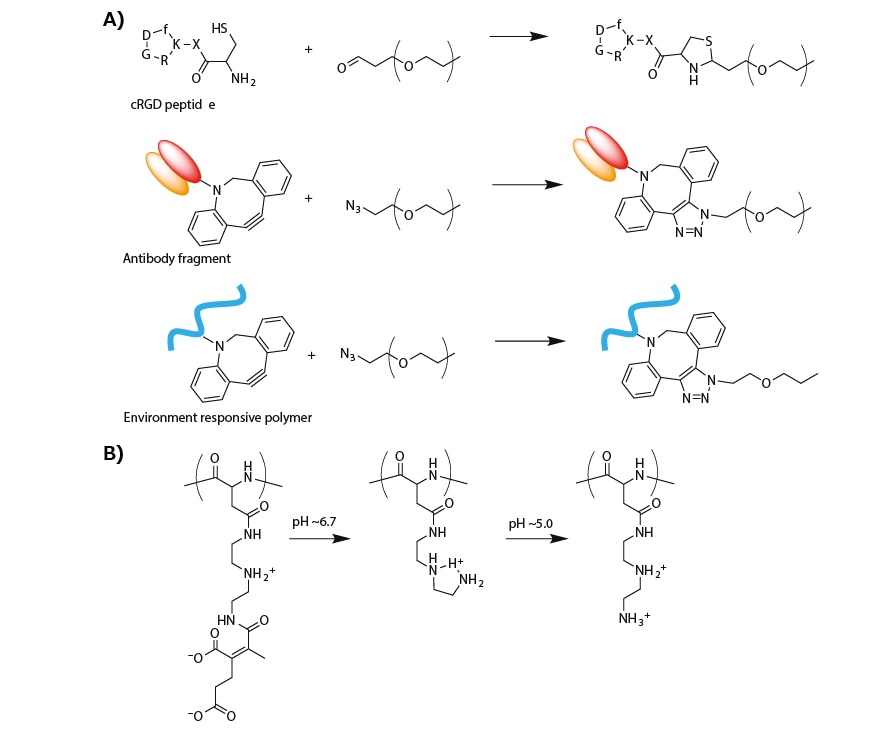
図3A)標的指向性を有する核酸医薬デリバリーのためのリガンド修飾PEGの合成ルート。B)生体環境でのpH変化によって誘起されるPAsp(DET-CDM)の化学構造変化。
筆者らの最近の研究で、グルコースリガンドで修飾したミセル型PICが血液-脳関門(BBB:blood-brain barrier)を通過することを報告しています。具体的には、血流中を循環するグルコース修飾ミセルは、脳毛細血管内皮細胞の表面で過剰発現している1型グルコース輸送体(GLUT1:glucose-transporter 1)に認識され、脳実質部に移行することが示されています24。ここで用いられた末端にグルコースと一級アミンを持つPEG(Glu-PEG-NH2)は、グルコースの6位の水酸基で開始するエチレンオキシド重合と末端アミノ化によって合成されています。結果として、マウスの静脈内に投与されたグルコース修飾ミセルは、約6% dose/g brainという非常に高い効率で脳組織に集積しました。グルコース修飾ミセルによるBBBの突破は、血糖値の変化に連動して、脳毛細血管内皮細胞でGLUT1がリサイクルされる機構に依存すると考えられています24。このグルコースリガンドを介した脳標的化は、脳疾患治療に向けた核酸医薬デリバリーへの応用が期待されています。
腫瘍組織内の弱酸性環境およびエンドソーム内の酸性環境に応答するデリバリーシステムも研究されています。具体例として、生体内でのpH変化に伴って化学(またはプロトン化)構造を段階的に変化させる、双性イオン性のポリアスパルアミド誘導体(PAsp(DET-CDM))が挙げられます25。この誘導体は、ポリアスパラギン酸(PAsp)の側鎖カルボキシ基にジエチレントリアミン(DET)およびマレイン酸カルボキシジメチル(CDM)を導入することで合成されます。この誘導体では、CDM部分が弱酸性の腫瘍微小環境(pH ≈ 6.7)に応答して、PAsp主鎖から脱離します(図3B)。さらに、DET部分が酸性の後期エンドソーム内(pH ≈ 5.0)でモノプロトン化状態からジプロトン化状態に移行します(図3B)。この構造変化を利用することで、PAsp(DET-CDM)で修飾されたミセル型PICは、腫瘍組織内でがん細胞に吸着すると共に、エンドサイトーシスを介してがん細胞内に移行した後、後期エンドソームから細胞質に移行することができます。すなわち、PAsp(DET-CDM)は、腫瘍組織内(pH ≈ 6.7)でわずかに正に帯電したモノプロトン化PAsp(DET)になり、負に帯電したがん細胞表面に吸着します。次いで、モノプロトン化PAsp(DET)は、後期エンドソーム内(pH ≈ 5.0)で正に大きく帯電したジプロトン化PAps(DET)になり、エンドソーム膜を不安定化することができます。実際に、PAsp(DET-CDM)で修飾されたsiRNA内包ミセル型PICは、未修飾のものと比べ、弱酸性環境で培養された肺がん細胞に対して効率的な遺伝子発現抑制(RNA干渉)効果を示しました25。
要約
この概説では、PEG-PLysとその化学修飾体を用いて調製される核酸医薬内包PICについて説明しました。ミセル型PICは、その化学修飾に応じて多様な機能を発揮し、一部のミセル型PICは、がん遺伝子を標的とする核酸医薬をデリバリーすることで、マウス担がんモデルにおいて優れた抗腫瘍効果を示しています。このような実験動物での成功例があるにもかかわらず、ポリマー系の核酸医薬デリバリーシステムの臨床試験の数は多くありません。臨床試験における核酸医薬治療の現在の課題の1つは、大部分が腎臓から排泄されてしまい、標的とする臓器・組織への集積効率が低いことです26,27。ここで述べたような化学修飾によりミセル型PICを安定化することで、腎臓からの排泄を抑えることができます。筆者らの研究を含め、ポリマー材料の合理的な設計により核酸医薬内包PICの臨床開発が進み、新たな核酸医薬治療が拓かれることを期待します。
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?