細胞生存率と細胞増殖のMTTアッセイプロトコル
はじめに
MTTアッセイは、細胞生存率、細胞増殖、および細胞毒性の指標として細胞の代謝活性を測定するために使用されます。この比色分析法では、黄色テトラゾリウム塩(3-(4, 5-ジメチル-チアゾール-2-イル)-2, 5-ジフェニルテトラゾリウムブロマイド、略してMTT)を紫色ホルマザン結晶に還元する細胞の代謝活性を測定します(図1)。6、7、35 生細胞には、MTTをホルマザンに還元するNAD(P)H依存性酸化還元酵素が含まれています。36 不溶性ホルマザン結晶は可溶化溶液を用いて溶解され、得られた着色溶液は、マルチウェル分光光度計を使用して500〜600ナノメートルでの吸光度を測定することによって定量化されます。溶液の色が濃いほど、代謝活性を持つ生細胞の数が多くなります。
MTTを使用したこの非放射性比色分析システムは、T Mosmann他1によって最初に提唱された後、他の研究者たちによって改良されました。2~6 細胞増殖キットI(MTT)は、すぐに使用できる試薬を含む最適化されたMTTアッセイキットであり、洗浄ステップや追加の試薬を必要としません。多数のサンプルを迅速かつ効率的に処理できる定量アッセイです。細胞増殖キットI(MTT)は、次のような複数の用途に使用できます。
- 細胞増殖と細胞生存率の定量化。1、3、5~7
- 成長因子、サイトカインおよび栄養素に応答した細胞増殖の測定。1~3、6、8~12(図3を参照)
- 細胞毒性の測定。たとえば、腫瘍壊死因子TNF-aまたはTNF-bの影響13、14(図2を参照)あるいはマクロファージ誘導性細胞死の定量化15、16、細胞毒性17~34または阻害抗体などの成長阻害剤の評価などです。
- 細胞の活性化の研究。4
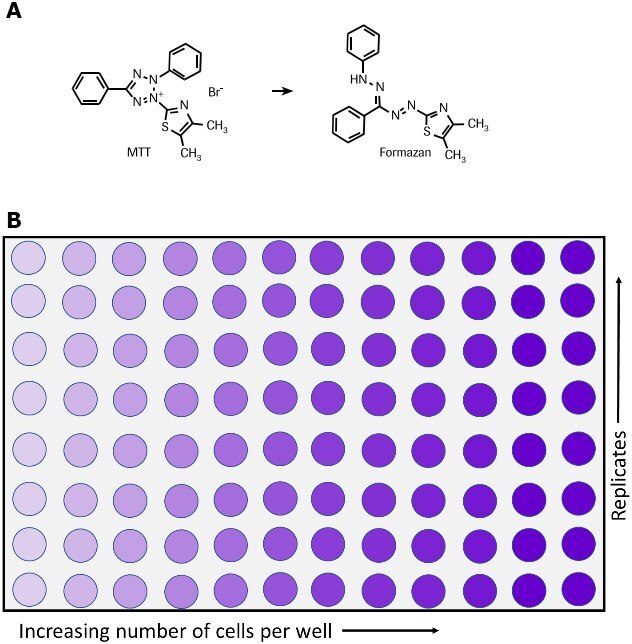
図1.化学反応(A)および96ウェルプレート(B)で示す、生細胞によるMTTのホルマザン塩への代謝。
キットの内容(カタログ番号11465007001)
MTT試薬
- 調製済み、非滅菌
- 5 ml MTT(3- [4,5-ジメチルチアゾール-2-イル] -2,5-ジフェニルテトラゾリウムブロミド)(1x)を含むバイアル5個、リン酸緩衝生理食塩水(PBS、806552)中5 mg/ml
可溶化溶液
- 1x、調製済み
- 90 ml入り3瓶。
細胞毒性測定用のアッセイプロトコール
その他の必要な試薬:
- 培地。10%の熱不活化FCS(ウシ胎児血清、12106C)、2 mMグルタミン(G6392)、1 µg/mlアクチノマイシンC1(アクチノマイシンD、A9415)、などを含んだRPMI 1640(R0883)。
- 抗生物質を使用する場合は、培地にペニシリン/ストレプトマイシンまたはゲンタマイシンを追加で添加してください
- ヒト腫瘍壊死因子-α(hTNF-α)(10 µg/ml)、無菌(T6674)。
プロトコル:
WEHI-164細胞(マウス線維肉腫、87022501)に対するヒト腫瘍壊死因子-α(hTNF-α、T6674)の細胞毒性効果を測定するため(図2)。
- 1 × 106細胞/mlの濃度のWEHI-164細胞を、1 µg/mlアクチノマイシンC1を含んだ培地で37 ℃および5〜6.5% CO2の条件下で3時間プレインキュベートします。
- 1 µg/mlのアクチノマイシンC1とさまざまな量のhTNF-αを含んだ100 µlの培地(最終濃度は0.001〜0.5 ng/mlなど)の細胞(5 × 104細胞/ウェルの濃度)をマイクロプレート(組織培養グレード、96ウェル、平底)に播種します。
- 細胞培養を+37 ℃および5〜6.5% CO2の条件下で24時間インキュベートします。
- インキュベーション期間の後で、10 µLのMTT標識試薬(最終濃度は0.5 mg/ml)を各ウェルに加えます。
- マイクロプレートを高湿度環境下(+37 ℃、5〜6.5% CO2など)で4時間インキュベートします。
- 100 µLの可溶化溶液を各ウェルに加えます。
- 高湿度環境下(+37 ℃、5〜6.5% CO2など)のインキュベータ内でプレートを一晩放置します。
- 紫色ホルマザン結晶が完全に可溶化されていることを確認し、マイクロプレート(ELISA)リーダーを使用してサンプルの吸光度を測定します。ホルマザン生成物の吸光度を測定する波長は、550〜600 nmです(使用するELISAリーダーに搭載されたフィルターによります)。リファレンス波長は650 nm以上となります。
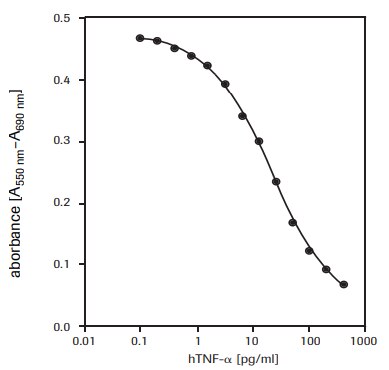
図2.WEHI-164細胞(マウス線維肉腫)に対する組換え型ヒトTNF-α(hTNF-α)の細胞毒性活性をMTTアッセイを使用して測定。
細胞増殖測定用のアッセイプロトコル
その他の必要な試薬:
培地。10%の熱不活化FCS(ウシ胎児血清、12106C)、2 mMグルタミン(G6392)、0.55 mM L-アルギニン(A8094)、0.24 mM L-アスパラギン一水和物(A4284)、50 µM2-メルカプトエタノール(M3148)、0.1 mMヒポキサンチンと16 µMチミジンを含んだHT培地サプリメント(H0137)(1x)、などを含んだDMEM(D5671)。抗生物質を使用する場合は、培地にペニシリン/ストレプトマイシンまたはゲンタマイシンを追加で添加してください。インターロイキン-6、ヒト(hIL-6、SRP3096)(200,000 U/mL、2 µg/mL)滅菌。
プロトコル:
7TD1細胞(マウス-マウスハイブリドーマ、DSMZ、ACC 23)に対するヒトインターロイキン-6(hIL-6)活性を測定するため(図3を参照)。
- さまざまな量のIL-6を含んだ100 µLの培地(最終濃度は0.1~10 U/mL(0.001~0.1 ng/mL)など)の7TD1細胞(2 × 103細胞/ウェルの濃度)をマイクロプレート(組織培養グレード、96ウェル、平底)に播種します。
- 細胞培養を+37 ℃および5〜6.5% CO2の条件下で4日間インキュベートします。
- インキュベーション期間の後で、10 µLのMTT標識試薬(最終濃度は0.5 mg/ml)を各ウェルに加えます。
- マイクロプレートを高湿度環境下(+37 ℃、5〜6.5% CO2など)で4時間インキュベートします。
- 100 µLの可溶化溶液を各ウェルに加えます。
- 高湿度環境下(+37 ℃、5〜6.5% CO2など)のインキュベータ内でプレートを一晩放置します。
- 紫色ホルマザン結晶が完全に可溶化されていることを確認し、マイクロプレート(ELISA)リーダーを使用してサンプルの分光吸光度を測定します。ホルマザン生成物の吸光度を測定する波長は、550〜600 nmです( ELISAリーダーに搭載されたフィルターによります)。リファレンス波長は650 nm以上となります。
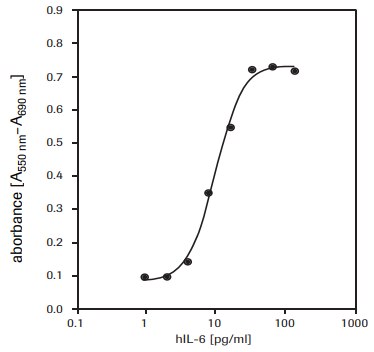
図3.組換えヒトインターロイキン-6(hIL-6)に応答した7TD1細胞(マウス-マウスハイブリドーマ)の増殖をMTTアッセイで測定。
同様のアッセイ
XTTアッセイとWST-1アッセイも細胞生存率と細胞増殖を測定するために使用できます。
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?