プロトコルガイド:細胞生存率と細胞増殖のXTTアッセイ
はじめに
細胞増殖キットII(XTT)(製品番号11465015001)は、細胞増殖、生存率、および細胞毒性の非放射活性定量のための比色分析法です。サンプル物質は、96ウェルマイクロプレートで培養した接着細胞または浮遊細胞のいずれかです。XTT(ナトリウム3´-[1-(フェニルアミノカルボニル)-3,4-テトラゾリウム]-ビス(4-メトキシ6-ニトロ)ベンゼンスルホン酸水和物)を使用する非放射性比色分析システムは、Scudiero, P.A.他によって最初に提唱された後1、2、他の研究者たちによって改良されました。3、4 XTTアッセイは、細胞生存率、細胞増殖、および細胞毒性の指標として、細胞の代謝活性を測定するために使用されます。この比色分析法では、黄色テトラゾリウム塩(ナトリウム3´-[1-(フェニルアミノカルボニル)-3,4-テトラゾリウム]-ビス(4-メトキシ6-ニトロ)ベンゼンスルホン酸水和物、略してXTT)をオレンジ色ホルマザン染料に還元する細胞の代謝活性を測定します(図1)。5 形成されたホルマザン色素は、水溶液に可溶であり、走査型マルチウェル分光光度計(ELISAリーダー)を使用して直接定量化されます。生細胞の数が増えると、サンプル中のミトコンドリアデヒドロゲナーゼの全体的な活性が高くなります。この増加は、吸光度で観察されるとおり、形成されるオレンジ色ホルマザンの量と直接相関しています(図2)。
このアッセイは、成長因子、サイトカイン、栄養素に応答した細胞増殖の測定に使用されます(図2)。また、腫瘍壊死因子TNF-αまたはβの影響の定量化(図3)や、細胞毒性剤または増殖阻害剤(阻害抗体など)の評価をはじめ、細胞毒性の測定にも使用されます。

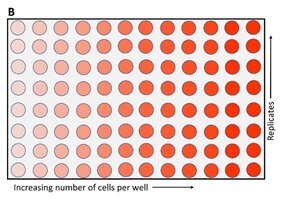
図1生細胞による水溶性オレンジ色ホルマザン塩へのXTTの代謝。XTTアッセイプレートの概略図。
細胞増殖キットII(XTT)(製品番号11465015001)の内容
XTT試薬
- 25 mL XTT(ナトリウム3´-[1-(フェニルアミノカルボニル)-3,4-テトラゾリウム]-ビス(4-メトキシ6-ニトロ)ベンゼンスルホン酸水和物)を含むバイアル5個、RPMI 1640中1 mg/mL
電子カップリング試薬
- 5 x 0.5 mL PMS(N-メチルジベンゾピラジンメチルサルフェート)
XTT標識ミックスの調製
- XTT標識試薬と電子カップリング試薬を37 ℃の水槽で解凍します。各バイアルをよく混ぜて溶液を透明にします。
- 1つのマイクロプレート(96ウェル)で細胞増殖アッセイ(XTT)を実施するには、5 mLのXTT標識試薬を0.1 mLの電子カップリング試薬と混合します。
注記:信頼性の高い結果を得るため、XTT標識試薬と電子カップリング試薬は使用直前に解凍して混合してください。
細胞増殖測定用のアッセイプロトコル
7TD1細胞(マウス-マウスハイブリドーマ、DSMZ、ACC 23)に対するヒトインターロイキン-6(hIL-6)活性を測定するため(図2)。
その他の必要な試薬:
- 培地。10%の熱不活化FBS(ウシ胎児血清、製品番号12106C)、2 mMグルタミン(製品番号G6392)、0.55 mM L-アルギニン(製品番号A8094)、0.24 mM L-アスパラギン一水和物(A4284)、50 µM2-メルカプトエタノール(製品番号M3148)、0.1 mMヒポキサンチンと16 µMチミジンを含んだHT培地サプリメント(製品番号H0137)(1X)、などを含んだDMEM(製品番号D5671)。
- ヒトインターロイキン-6(hIL-6、製品番号SRP3096)(200,000 U/ml、2 µg/mL)滅菌。
- 抗生物質を使用する場合は、培地にペニシリン/ストレプトマイシンまたはゲンタマイシンを追加で添加してください。
プロトコル:
- さまざまな量のIL-6を含んだ100 µLの培地(最終濃度は0.1~10 U/mL(0.001~0.1 ng/mL)など)の7TD1細胞(4 × 103細胞/ウェルの濃度)をマイクロプレート(組織培養グレード、96ウェル、平底)に播種します。
- 細胞培養を+37℃および5〜6.5% CO2の条件下で4日間インキュベートします。
- ウェルあたり50 µLのXTT標識ミックスを加えて、37 ℃および5〜6.5% CO2の条件下で4時間インキュベートします。
- マイクロプレート(ELISA)リーダーを使用してサンプルの分光吸光度を測定します。ホルマザン生成物の吸光度を測定する波長は、550〜600 nmです(使用するELISAリーダーに搭載されたフィルターによります)。リファレンス波長は650 nm以上となります。
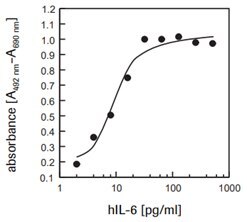
図2組換えヒトインターロイキン-6(hIL-6)に応答した7TD1細胞(マウス-マウスハイブリドーマ)の増殖をXTTアッセイで測定。
細胞毒性測定用のアッセイプロトコル
WEHI-164細胞(マウス線維肉腫、製品番号87022501)に対するヒト腫瘍壊死因子-α(hTNF-α、T6674)の細胞毒性効果を測定するため(図3)。
その他の必要な試薬:
- 培地。10%の熱不活化ウシ胎児血清(FBS、製品番号12106C)、2 mMグルタミン(製品番号G6392)、1 µg/mLアクチノマイシンC1(アクチノマイシンD、製品番号A9415)などを含んだRPMI 1640(製品番号R0883)。
- 腫瘍壊死因子-α、ヒト(hTNF-α、製品番号T6674)(10 µg/mL)、無菌。
- 抗生物質を使用する場合は、培地にペニシリン/ストレプトマイシンまたはゲンタマイシンを追加で添加してください
プロトコル:
- 1 × 106細胞/mlの濃度のWEHI-164細胞を、1 µg/mlアクチノマイシンC1を含んだ培地で37℃および5〜6.5% CO2の条件下で3時間プレインキュベートします。
- 1 µg/mLのアクチノマイシンC1とさまざまな量のhTNF-αを含んだ100 µLの培地(最終濃度は0.001〜0.5 ng/mLなど)の細胞(5 × 104細胞/ウェルの濃度)をマイクロプレート(組織培養グレード、96ウェル、平底)に播種します。
- 細胞培養を+37℃および5〜6.5% CO2の条件下で24時間インキュベートします。
- 50 µLのXTT標識ミックスを加えて、37℃および5〜6.5% CO2の条件下で18時間インキュベートします。
- マイクロプレート(ELISA)リーダーを使用してサンプルの吸光度を測定します。ホルマザン生成物の吸光度を測定する波長は、550〜600 nmです(使用するELISAリーダーに搭載されたフィルターによります)。基準波長は650 nm以上となります。
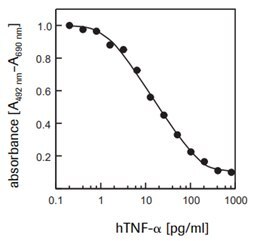
図3WEHI-164細胞(マウス線維肉腫)に対する組換え型ヒトTNF-α(hTNF-α)の細胞毒性活性をXTTアッセイを使用して測定
同様のアッセイ
MTTアッセイとWST-1アッセイも細胞生存率と細胞増殖を測定するために使用できます。
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?