プロトコルガイド:細胞増殖能・生存率測定のためのWST-1アッセイ
プロトコル・FAQ・トラブルシューティングガイド
製品番号:CELLPRO-RO
はじめに
細胞増殖・細胞生存率の測定は、ライフサイエンスにおいて重要な技術となっています。高感度で、信頼性のある、迅速で容易な方法の必要性から、いくつかの標準アッセイが開発されました。増殖アッセイは、培地に添加したテトラゾリウム塩の切断により生存細胞数の解析に利用できるようになりました。テトラゾリウム塩は、細胞内の酵素によってホルマザンに切断されます(図1)。生存細胞数の増加は、サンプル中のミトコンドリアデヒドロゲナーゼの全体の活性の増加をもたらし、順を追ってホルマザン色素量が増加します。走査型マルチウェル吸光光度計を用いることにより、代謝活性を有する細胞により産生されたホルマザン色素の定量が可能です。
細胞増殖測定試薬WST-1は、96ウェルプレート形式を使用した、細胞集団中の細胞増殖・生育・生存率・化学感受性の放射性物質不使用分光光度定量に使用するために設計されています。本キットは以下のことに使用できます:
- 成長因子・サイトカイン・栄養素(図2)に応じた細胞増殖の測定
- 増殖阻害抗体・生理学的メディエーターの測定
- 抗がん剤・その他の医薬品など細胞毒性・細胞増殖抑制化合物の解析
![テトラゾリウム塩WST-1 (4-[3-(4-Iodophenyl)-2-(4-nitro-phenyl)-2H-5-tetrazolio]-1,3-benzene sulfonate)からホルマザンへの切断。(EC=電子結合試薬、RS=ミトコンドリアコハク酸塩テトラゾリウム還元酵素系)。 テトラゾリウム塩の切断](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/protocols/cell-culture-and-analysis/cell-counting-and-health-analysis/formazen-dark-red/formazen-dark-red.png)
図1.テトラゾリウム塩WST-1 (4-[3-(4-Iodophenyl)-2-(4-nitro-phenyl)-2H-5-tetrazolio]-1,3-benzene sulfonate)からホルマザンへの切断。(EC=電子結合試薬、RS=ミトコンドリアコハク酸塩テトラゾリウム還元酵素系)。
キットのコンポーネント(カタログ番号CELLPRO-RO)
細胞増殖試薬測定WST-1は、澄明で微赤色のすぐに使用できる溶液であり、WST-1・電子結合試薬を含有しており、リン酸緩衝生理食塩水で希釈し、0.2 μm孔径メンブレンでろ過されています。
対照(ブランク)
実験での使用量と等量の培養培地+細胞増殖試薬測定WST-1をウェル1個に添加します(例:培養培地100 μL+WST-110 μL)。このバックグラウンドコントロールをELISAリーダーのブランクとして使用します。バックグラウンド吸光度は、培養培地・インキュベーション時間・露光によって変動します。通常、2時間後のバックグラウンド吸光度は0.1~0.2 AU(absorbance unit)です。
細胞増殖を測定するアッセイプロトコル
マウスT細胞株CTLL-2 (93042610)でのヒトインターロイキン-2 (hIL-2)活性測定 (図2)
必要な追加試薬:
- 培養培地、例えば10%熱不活化FCS(ウシ胎児血清、12106C)・2 mMグルタミン(G6392)含有RPMI 1640 (R0883)。
- インターロイキン-2、ヒト(hIL-2、SRP3085)無菌。
- 抗生物質を使用する場合、ペニシリン/ストレプトマイシンまたはゲンタマイシン含有培地を追加補充します。
プロトコル:
- マイクロプレート(組織培養グレード、96ウェル、平底)に、CTLL-2 細胞を4 × 103 cells/ウェル、様々な量のIL-2(最終濃度、例えば0.005~25 ng/mL)を含有する培養培地100 μLの濃度で播種します。
- 細胞をインキュベートします(48時間、37℃、5% CO2)。
- 細胞増殖試薬測定WST-1、10 μL/ウェルを添加し、インキュベートします(4時間、37℃、5% CO2)。
- シェイカーで1分、十分に振とうします。
- マイクロプレート(ELISA)リーダーを用いて、ブランクであるバックグラウンドコントロールに対するサンプルの吸光度を測定します。ホルマザン産生物の吸光度測定の波長は、ELISAリーダーに使用できるフィルターに準じた420~480 nm(約440 nmで最大吸光度)です。標準の波長は600 nm超とします。
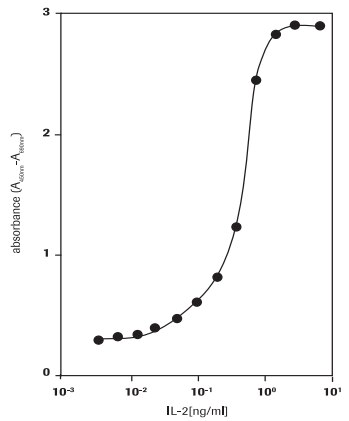
図2.WST-1アッセイによる、ヒトIL-2に反応したCTLL-2細胞の増殖の測定。
細胞毒性を測定するアッセイプロトコル
WEHI-164細胞(マウス線維肉腫細胞株、87022501)でのヒト腫瘍壊死因子-α(hTNF-α、T6674)の細胞毒性作用の測定(図3)。
必要な追加試薬:
- 培養培地、例えば10%熱不活化FCS(ウシ胎児血清、12106C)・2 mMグルタミン(G6392)・1μg/mLアクチノマイシンC1(アクチノマイシンD、A9415)含有RPMI 1640 (R0883)。
- 腫瘍壊死因子-α、ヒト(hTNF-α、T6674)(10 μg/mL)、無菌。
- 抗生物質を使用する場合、ペニシリン/ストレプトマイシンまたはゲンタマイシン含有培地を追加補充します。
プロトコル:
- マイクロプレート中培養細胞(組織培養グレード、96ウェル、平底)、最終容量100 μL/ウェル培養培地、加湿環境下(37℃、5% CO2)。
- マイクロプレート(組織培養グレード、96ウェル、平底)に、細胞を5 × 104cells/ウェル、1 μg/mLアクチノマイシンC1・様々な量のhTNF-α(最終濃度、例えば0.001~0.5 ng/mL)を含有する培養培地100 μLの濃度で播種します。
- 細胞をインキュベートします(24時間、37℃、5% CO2)。
- 細胞増殖試薬測定WST-1、10 μL/ウェルを添加し、インキュベートします(4時間、37℃、5% CO2)。
- シェイカーで1分、十分に振とうします。
- マイクロプレート(ELISA)リーダーを用いて、ブランクであるバックグラウンドコントロールに対するサンプルの吸光度を測定します。ホルマザン産生物の吸光度測定の波長は、ELISAリーダーに使用できるフィルターに準じた420~480 nmです(図3)。標準の波長は600 nm超とします。
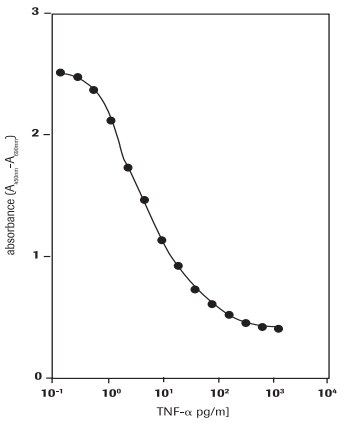
図3.WST-1アッセイによる、WEHI-164細胞(マウス線維肉腫細胞株)に対するヒトTNF-α(hTNF-α)の細胞毒性活性の測定。
よくある質問・トラブルシューティング
1.CELLPRO-ROキットは酵母または細菌と併用できますか?
これらのキットを細菌または酵母の増殖の測定に使用したデータはありません。また、これらのキットはこの目的のために開発されたものではありません。細菌または酵母の増殖を測定する最も容易な方法は、ODの測定であると考えられます。
2.測定まで細胞が沈降するのを待つ必要がありますか?
細胞は測定に干渉しないため、細胞をウェルの底部に沈降させる必要はありません。WST-1切断の定量に用いる波長では細胞は吸光しません。したがって、添付文書のプロトコルに記載のとおり、さらなるステップなしで振とう直後に測定することが可能です。
3.細胞増殖試薬測定WST-1と細胞増殖ELISA BrdU、比色分析を同時使用することはできますか?
Rocheの「Apoptosis, Cytotoxicity and Cell Proliferation Manual」4th editionの図52aでは、細胞生存率・細胞増殖測定のための、細胞増殖試薬測定WST-1と細胞増殖ELISA BrdU、比色分析の併用を示しています。プロトコルは図の凡例に示しています。同時アッセイを実施するには、両キットを注文する必要があり、必要な試薬等については添付文書に記載されています。
4.細胞増殖試薬測定WST-1・細胞増殖キットI(MTT)・細胞増殖キットII(XTT)を同時使用することはできますか?
MTT/XTT/WST-1アッセイは、異なるテトラゾリウム塩を用いて活性細胞の代謝活性を測定します。各キットが代謝活性の測定に要する波長は異なります(MTT 550 nm、XTT 492 nm、WST-1 420~480 nm)。各々の塩から得られるシグナルの識別は困難と考えられます。独立して確立されたキットによる試験の感度および直線検出範囲は、MTT・XTT・WST-1の複合塩により損なわれると考えられます。したがって、MTT・XTT・WST-1の同時使用は推奨しません。
5.WST-1反応を止めるにはどうしたらいいですか?
細胞増殖試薬測定WST-1の反応停止は、サンプル凍結、または1% Triton X-100/ 0.1% SDS(最終濃度)添加、室温(15~25℃または37℃)で5分のいずれかにより可能です。
トラブルシューティング
フェノールレッドおよび/またはFCSの干渉
フェノールレッドは、吸光度をわずか0.1 ODユニット増加させると考えられますが、陰性対照はこの増加の補填を可能にします。また、10%までのFCS添加は問題を起こしません。Rocheは、このキットのフェノールレッドまたはFCSに関する許容範囲について系統的な試験を実施していません。また、大量のFCSは問題を起こしません。一般的に、陰性対照は常にサンプルと同一方法で処理します。
ELISAアッセイ:
関連製品
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?