組織工学用足場作製における3Dプリンティング技術
Helena N. Chia, Ph.D<sup>1</sup>, Benjamin M. Wu, D.D.S, Ph.D<sup>1,2</sup>
はじめに
3Dプリンティングを用いることで、患者個別の解剖学的データから得られるコンピュータデザインに基づく複雑な組織工学用の足場を作製することができます。生物医学分野で最初に3Dプリンティングが用いられたのは、術前の可視化モデルと金型の作製でした。それ以降、3Dプリンティングの進歩により組織工学用の足場、組織に類似した構造、診断用の「Organ on a Chip(組織チップ)」が作製できるようになっています。近年3Dプリンティングに対する一般の関心が高まり、プリンターが入手しやすくなったことで、幹細胞技術とカスタム三次元(3D)足場を組み合わせた個別化再生医療の分野が開拓されています。ただし、骨、軟骨、筋肉、血管などの複雑な組織や、肝臓、リンパ器官のように入り組んだ三次元微細構造を持つ複雑な臓器の再生に3Dプリンティングが用いられるようになるまでには、対処しなければならないいくつかの技術的問題があります。本稿では、組織工学用足場の3Dプリンティングの進歩をもたらしている技術革新、3Dプリンティングによる足場の作製に現在使用されている材料、残されている課題について説明します。
3Dプリンティングでは多くの場合、1層ずつ立体を造形します。一般的な3Dプリンティングの手順を以下に示します。(1)医用画像データもしくはコンピュータ支援設計(CAD)を用いて正確な3Dコンピュータモデルを作成する。(2)3Dモデルを薄く切って二次元(2D)の連続スライスにする。(3)コンピュータ制御で各スライスを1層ずつ作製する。(4)ナノ構造を付与するための表面処理などの後処理を行う。この方法では、内部が空洞の形状や長くせり出した形、下からくり抜いた形、細く曲がりくねった形などの複雑な3D構造が、円、線、点などの一般的な2D図形の積み重ねとして表されます。工具を使用する場合は物理的にアクセス可能な部分からしか材料を除去できないのに対して、積層法ではこのような制限を受けないため遥かに複雑な形状を作製できます。このように複雑な3D形状を作製できることから、生物医学工学分野で非常に大きな関心を集めており、生物医学および組織工学用途では、制御されたマクロ構造やミクロ構造を含む物体の作製に多様な3Dプリンティング法が導入されています。形状と堆積方法を自由に組み合わせることで、組織工学の三要素である細胞、シグナル因子、足場を精密に制御することができるため、生物医学分野の研究で3Dプリンティングの採用が急速に進んでいます。
3Dプリンティングの中核となる特許が満了し、膨大な3Dデータを処理する計算能力が手ごろな費用で利用可能になったことで、3Dプリンティング分野が爆発的に成長しています。現在では、患者固有のマクロ構造およびミクロ構造を有する複雑な3D構造を設計、作製することが技術革新により可能になっています。オープンソースソフトウェアのFreeCADやその他CADアプリケーションを利用すれば、部品の設計や共有を家庭でも行うことができます。現在、低コストで高解像度の3Dスキャナを使用して3D画像を得ることが可能で、スマートフォンで3Dスキャンを行うアプリも開発中です。これら技術革新が、より多くの人々の間での3Dプリンティングの人気や手軽さにつながっています。一般消費者向けに開発された3Dプリンターも足場の作製に使用可能です。高性能機器が手軽に入手できるようになることで、3Dプリンティングに用いることのできる生体材料の種類が広がり、3Dプリンティングに残された根本的な課題の解決につながります。以下で、3Dプリンティングの各方法を簡単に紹介し、現在使用されている材料について議論します。
粉末3Dプリンティング
マサチューセッツ工科大学で開発された粉末3Dプリンターは、インクジェットからバインダー溶液を粉体層に滴下して3D構造を作製します1–3。粉末3Dプリンティング法では、最初に微細粉末材料の層をピストンの上に均等に広げます。X-Y位置決めシステムとプリントヘッドを同期して粉体層にバインダー液滴を滴下する位置を選択し、目的の2Dパターンを造形します。プリント後、ピストンと粉体層、プリントした部分を下げて、次の粉体層を広げます(図1)。
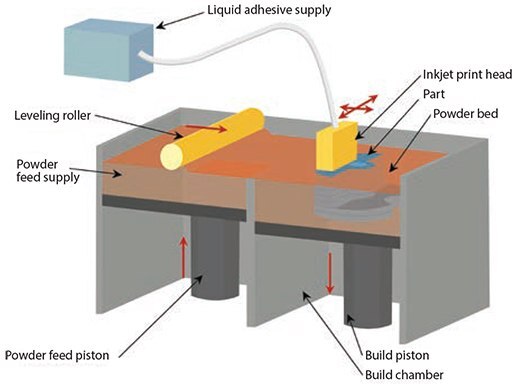
図1粉末3Dプリンティングの概略図。バインダーによって粉末を2Dパターンに固定し、プリントが完了した後に固定されなかった粉末を除去します。
部品全体が完成するまで、このdrop-spread-printのサイクルを繰り返します。結合していない粉末を除去すると、作製した部品が得られます。ペプチド、タンパク質(フィブリノゲン、コラーゲンなど)、多糖類(ヒアルロン酸やアルギン酸など)、プラスミドDNA、生きた細胞などの生体材料を、バインダーに加えるか粉末として処理して3Dプリンティングを直接行うことができます。これまでに使用された他の材料として、有機溶媒をバインダーにした合成ポリマー(ポリ(ε-カプロラクトン)、ポリ(ラクチド–co-グリコリド)共重合体、ポリ(L-乳酸)など)や、水をバインダーにした天然ポリマー粉末(デンプン、デキストラン、ゼラチン)があります。現在では、セラミックス(リン酸三カルシウム、ヒドロキシアパタイト、ポリリン酸カルシウムなど)、合成ポリマー(ポリビニルアルコール、PLGA、PCLなど)、天然ポリマー[コラーゲンやキトサン]が使用されています。通常、これら生体材料を使用するために特別な修飾や官能基化などは不要ですが、粉末状でなければなりません。ウサギ、ラット、マウスのモデルでこれら材料を使用して骨欠損(頭蓋冠骨、脛骨、大腿骨)を修復するin vivo の研究が行われています4–9。他にも、ショ糖、乳糖、食卓塩などのポロゲン(porogen)を印刷することで目的の形状を作製し、その空間をポリマー溶液で満たした後、ポロゲンを溶解することでバイオポリマーの3D部品が得ることができます10。
熱溶解積層法(FDM)
熱溶解積層法(FDM:Fused-deposition Modeling)は、各々が小さなノズルを持つ2つの加熱押出ヘッドを使用して、溶解した熱可塑性材料を特定のパターンに堆積させる方法です11。一方のノズルで造形用の熱可塑性材料を堆積し、もう一方のノズルで造形した形を補強するためのサポート材を堆積します(図2)。従来型のFDM法の一つでは、熱可塑性ポリマーを溶解して半液体状にしたものをヘッドから作製プラットフォーム上に押し出します。FDM法で使用する材料を選択する際に最も重要な基準は、熱伝達特性とレオロジー(液体の流動挙動)です。材料を横向きのパターンに流すために、融点が低い熱可塑性プラスチックが通常選択されます。PVC、ナイロン、ABS、インベストメント鋳造用ワックスの使用も成功しています。バイオ用途では、融点が低く(約60℃)、ガラス転移温度が低く(–60℃)、熱安定性に優れたPCLがよく使用されています。他にも、PLGA、TCP(合成ポリマーと組み合わせて使用)、PMMA、ポリ(エチレングリコール)テレフタレート、ポリ(ブチレン)テレフタレートなどが使用されています。また、これらの材料を組み合わせて使用する場合もあります。この方法は、動物モデル(創傷治癒マウスモデルやウサギの骨欠損など)12–14や、ヒト患者の頭蓋・顔面骨欠損の治療15を含む、複数のin vivo 研究で用いられています。

図2熱溶解積層法の概略。溶解した熱可塑性材料を特定のパターンに堆積します。
光造形法(SLA)
1980年代後半に開発された光造形法またはステレオリソグラフィー(SLA:Stereolithography)は、最初のラピッドプロトタイピング法として知られています16。当初のSLA法ではHeCdレーザーが用いられ、光硬化性樹脂の重合を空間的に制御して2Dパターンを作製します17。各層を硬化したあと、硬化した構造を載せたプラットフォームを下げることで(ボトムアップ法の場合)、未硬化の液体樹脂を最上面に広げます(図3)。液体樹脂を平滑に広げた後に、最上層にさらにパターンを作製することができます。トップダウン法の場合は、液体樹脂を入れた透明槽の底面付近に位置するプレートに、槽の下から光を照射します。各層が作製されるごとに構造を透明槽の底面から剥離します。SLA法ではアクリル類やエポキシ類が通常使用され、これら材料は、光架橋化のための光硬化性構造を含んでいる必要があります。組織工学用途の場合、SLA法における光重合に必要な寸法安定性を有する、生分解性及び生体適合性の生体材料の種類は非常に限られています。この数年の間に、生分解性を可能とする脂肪族ポリエステルを含有したポリマーがいくつか合成されています。光架橋化を可能にするため、得られたマクロモノマーを例えばポリ(エチレングリコール)ジアクリレート中でアクリル化します。こうした研究から、生分解性セグメントを持ち、プロセス中に細胞のカプセル化が可能な樹脂ライブラリーが拡充されています。これら新規マクロモノマーとして、PCLまたはポリ(D,L-ラクチド)、光架橋化が可能になるように末端基を修飾したPLLAレジン、PPF-DEFなどがあります。これらの材料がラットの頭蓋欠損において骨形成を促進することがin vivo の研究で示されています18。
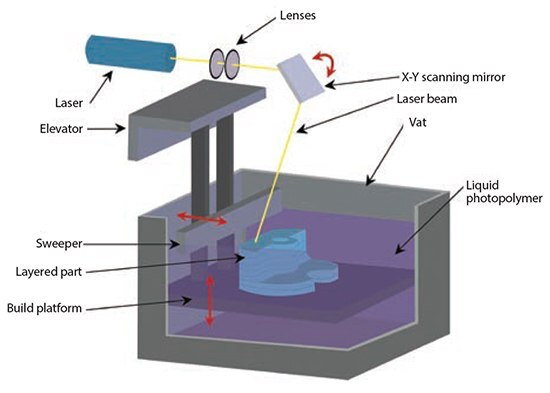
図3光重合可能な液体樹脂の層を使用した光造形法の概略図
選択的レーザー焼結法
選択的レーザー焼結法(SLS:Selective Laser Sintering)は1989年にテキサス大学で開発されました19。SLS法は、薄い層の形に粉末を互いに結合させるという点では粉末3Dプリンティングに類似していますが、材料の結合にはCO2レーザー光線を使用した焼結を用います20。粉末状のポリマー粒子の表面にレーザーを特定の2Dパターンで走査し、ガラス転移温度よりも高温にして焼結させます(図4)。焼結の際、粒子の最も外側の表面に沿って分子が拡散し、隣接する粒子間にネックを形成します。1つの層を作製したあと、部品を載せたピストンを下げて最表面に新しい粉体層を広げ、次の層を形成して前の層と結合させます。作製が完了後に結合していない粉末を除去し、十分な密度を得るために部品を熱処理します。PCLとヒアルロン酸などの粉末の組み合わせがよく使用されています。生物医学的応用例として、骨および血管の組織工学21や脊椎固定術用の椎体間固定ケージ22などがあります。
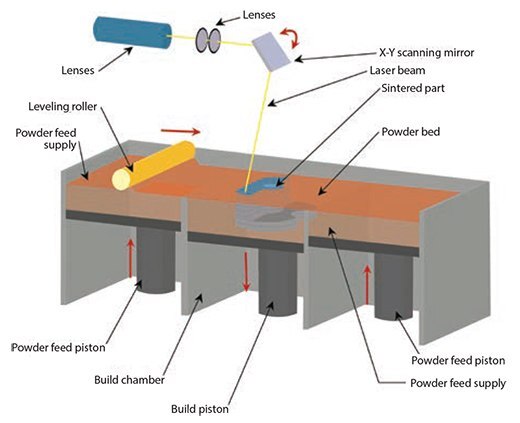
図4選択的レーザー焼結法
三次元プロッティング/直接描画バイオプリンティング法
三次元プロッティングは、軟組織の足場を作製するため、2000年にFreiburg Materials Research Centerで開発されました。この3Dプロッティングは、圧力をかけた注射器から粘性の高い液体材料(通常は溶液、ペースト、分散液)を密度を合わせた液体媒体中に押し出す方法です。1個のノズルまたは注射器から材料を1本の長く連続した紐状または個別の点として堆積し、セラミックス、ポリマー、ヒドロゲルの3D形状を作製します23。同様に、バイオプリンティングは細胞を直接組み込んだヒドロゲル構造の作製にも用いることが可能で、足場構造だけでなく、細胞や成長因子の空間分布を制御することができます。バイオプロッティング用の材料として、合成ポリマーや、コラーゲン、キトサン、アルギン酸、アガロース、ゼラチンなどの天然ポリマーが使用されています。細胞バイオプリンティングに適合するヒドロゲルの多くは、頭蓋冠骨欠損のような、機械的な強度が要求されない生物学的環境に埋め込む用途に最適です24。また、患者固有の薬物応答や細胞毒性を評価するための個別化された細胞ベースのチップ開発にもバイオプリンティングが利用されています25。
今後の方向性
この5年間で組織工学は大幅に進歩しましたが、発生した組織の神経分布および血管分布(組織内での神経および血管の発達)が大きな課題として残されています。循環系および神経制御系と統合した完全に機能する組織を3Dプリントするためには、胚形成や創傷治癒の状態を模倣した細胞や生化学分子の傾斜組成した材料を作製する必要があります。さらに、紫外光、熱、有機溶媒、細胞毒性を持つ光開始剤などを用いる処理の条件とは異なり、細胞を堆積するためには生体材料と完全に適合する材料と処理条件が要求されます。成長因子の放出プロファイルを時間的、空間的に制御して持続的に放出する方法を開発することが、生化学分子を組み入れるためには必要です。この分野をさらに進化させるには、3Dプリンティング技術の開発のみならず、これら課題の解決にも対処しなければなりません。
組織工学用の3Dプリンティング研究分野は現在非常に活気を帯びています。技術革新により、企業や大学の研究以外でも3Dプリンティングが利用しやすくなっており、より強固な足場の設計および作製が可能になっています。新しい材料や手法が次々と開発されており、DNA配列を用いて異なる種類の細胞を3Dに配置してオルガノイド(organoid、臓器に似た立体構造)のような組織を作製する(DNA-programmed assembly of cells; DPAC、DNAでプログラムされた細胞集合体)26など、生体適合性を有する足場の応用が拡大しています。こうした研究開発により、3Dプリンティングの開発が促進し、次世代組織工学用構造体の作製が可能となるでしょう。
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?