選択的メタル化、脱プロトン化、および1,2-付加反応のための新しい試薬
Josephine Nakhla
i-PrMgCl•LiClとs-BuMgCl•LiClを用いる選択的メタル化反応
有機金属試薬の調製にはハロゲン-メタル交換反応が一般的な手法ですが、Li-ハロゲン交換反応の場合には、官能基の適用性に制約がある、低温条件が必要になるなどの問題があります。一方、Mg-ハロゲン交換反応はより高い温度を必要とし、反応性が低いため、試薬がHX脱離(オレフィン生成)を起こしやすくなる場合もあります。Knochel らは、塩を添加することにより反応速度と効率が高まることを見出しました。最も効果の高い試薬は、R-MgCl(R = i-Pr、s-Bu)と1.0当量のLiClを用いて調製されました(ターボGrignard試薬(TurboGrignards)と命名)。反応性が向上する理由としては、典型的なGrignard試薬に存在することが知られている会合体の分解や、i-PrMgCl2-Li+のMgの負の電荷による反応性の向上が挙げられます。ターボGrignard試薬は、多様な官能基で修飾された感受性の高い基質(CO2R、CN、OMe、ハロゲンのような官能基を含有するものなど)を、アリールおよびヘテロアリールマグネシウム誘導体を含む対応する官能基を持つ有機金属試薬に変換することを可能にします。ターボGrignard試薬による速度の向上が観測されていますが、反応性の向上は反応の全体的な範囲に悪影響を及ぼすことなく、種々の官能基があっても変換反応が進行します(表1)。1

表1i-PrMgCl•LiClを使用して調製されたアリール/ヘテロアリールGrignard試薬および求電子剤との反応。(656984)
ターボGrignard試薬の利点を以下にまとめます:
- 官能基適合性の向上
- 温和な反応条件
- 扱いやすい温度範囲
- 副反応の抑制
- 修飾されたヘテロアリール有機金属化合物の調製
- 大量生産が実現可能
Knochel-Hauser塩基を使用する選択的脱プロトン化
芳香族化合物の脱プロトン化および修飾は合成の鍵となる変換反応です。しかし、アルキルリチウムやリチウムアミドなどの一般的な有機強塩基は、競争的な付加反応(Chichibabin反応)を起こします。さらに、多くのアミドは溶液中で安定性が低いため、in situで生成しなければなりません。最後に、これらの塩基を使用するときは低温が必要になるため、簡便に扱えるとは言えません。Knochelらは、アレーンおよびヘテロアレーンの位置選択的脱プロトン化における、2,2,6,6-テトラメチルピペリジニルマグネシウムクロリド塩化リチウム(TMPMgCl•LiCl)(Knochel-Hauser塩基)の使用について報告しています。求電子剤の付加を経由するさらなる合成の後、修飾されたアレーンおよびヘテロアレーンへの位置選択的なアクセスが優れた収率で達成されています。3TMPMgCl•LiClは、反応の範囲を拡大して多様な官能基を許容すると同時に、望ましくない副反応を抑制します(表2)。著者らは、TMPMgCl•LiClの存在下でオリゴマー状の会合体が分解されると考えています。
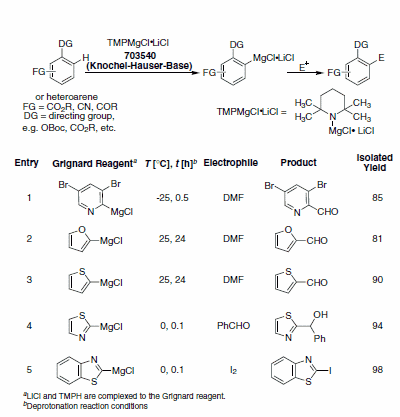
表2TMPMgCl•LiClを使用して調製されたヘテロアリールマグネシウムGrignard試薬および求電子剤との反応。(703540)
Knochel-Hauser塩基の利点を以下にまとめます:
- 高い官能基許容性
- LiClがもたらす高い速度論的活性
- アレーン/ヘテロアレーンの位置選択的メタル化
- Chichibabin反応なし
- 塩基性の増大
- THFに対する溶解性
LaCl3•2LiClによる選択的1,2-付加反応
ランタニド塩は、ケトン類への求核付加反応において、競争する還元およびエノール化の副反応を抑制することが示されています。しかし、ランタニド錯体の溶解性と乾燥方法の性質の両方を理由として、従来、その利用範囲は制限されていました。Knochelらは、LiClの添加が複数の有機金属試薬の反応性を向上させることをふまえ、LaCl3•2LiClを調製し、THFに可溶であることを見出しました。親酸素性のLaCl3•2LiClの存在下では、立体的に混みあいエノール化しやすいケトン類やMichael受容体、不活性イミンなども1,2-付加がクリーンに進行して目的物が得られ、反応の適用範囲が大きく広がりました(表3)。6
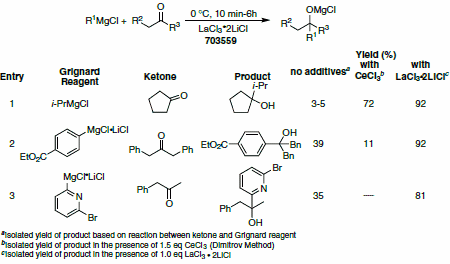
表3.ケトン類へのLaCl3•2LiCl媒介付加反応。(703559)
ランタニド塩-LiCl錯体を用いた最初の研究に続き、Knochelらは、i-PrMgCl•2LiClの不活性イミン誘導体への付加反応で示されているように、目的の1,2-付加反応を促進するには、ランタニド塩は当量以下で十分だったことを報告しています(スキーム2)。このプロトコルは、アルキル、アリール、ヘテロアリールの各Grignard試薬に対して適用可能でした。7
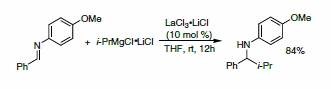
スキーム2:LaCl3•2LiCl触媒の存在下における有機マグネシウム試薬の1,2-付加反応
LaCl3•2LiClの利点を以下にまとめます:
- 水分含量が低い
- 前処理が不要
- 取り扱いが容易
- 均一な反応が得られる
- 簡便な反応条件
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?